(一)、水的电离
1、水的电离过程表示方法
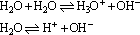
水的电离特点:
(1)水分子与水分子之间的相互作用而引起电离的发生;
(2)水是弱电解质,只有极少数水分子发生电离;
(3)水分子在电离产生H+的同时产生相同数目的OH-;
(4)25℃,纯水中,C(H+)=C(OH-)=1.0×10-7mol·L-1。
2、水的离子积常数
(1)在25℃时,纯水中的水的浓度可视为常数,故定义
Kw=C(H+)·C(OH-)=10-14为水的离子积常数。
(2)水的离子积常数可以推广到所有的稀溶液中,即在25℃时,稀溶液中存在
Kw=C(H+)·C(OH-)=10-14。
(3)Kw只与温度有关,温度改变,Kw就发生改变,与C(H+)和C(OH-)等均无关。
(4)在水和水溶液中,既有OH-又有H+,但H+和OH-不能大量共存。
3、影响水的电离程度的因素
(1)温度
因为水的电离是一个吸热过程,升高温度可以促进水的电离。
(2)酸(或碱)
酸(或碱)加入到水中增加了H+和(或OH-)的浓度,使水的电离平衡向左移动,抑制了水的电离。
(二)、溶液的pH和溶液的酸碱性
1、溶液的pH
pH=-lg{C(H+)}
pH是溶液中C(H+)的变式表示,溶液中存在Kw=C(H+)·C(OH-);因此pH与溶液的酸碱性有密切关系。
pH在25℃时一般取值范围常为:0~14,只是用来表示C(H+)很小的溶液。
2、溶液的酸碱性
科学规定:C(H+)=C(OH-)的溶液为中性溶液;
C(H+)>C(OH-)的溶液为酸性溶液;
C(H+)<C(OH-)的溶液为碱性溶液。
在25℃时,pH>7的溶液为碱性溶液;pH=7的溶液为中性;pH<7的溶液为酸性溶液。
(一)、溶液pH的计算方法(25℃)
1、酸溶液
(1)强酸溶液,如HnA,设物质的量浓度为C mol·L-1,C(H+)=nC mol·L-1,pH=-lgC(H+)=-lg(nc)。
(2)一元弱酸溶液,设物质的量浓度为C mol·L-1,电离度为α,则C(H+)=C·α,pH=-lg(Cα)。
(3)两强酸混合
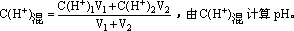
2、碱溶液
(1)强碱溶液,如B(OH)n,设物质的量为
C mol·L-1,C(OH-)=nC mol·L-1,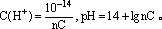
(2)一元弱碱溶液,设物质的量浓度为C mol·L-1,电离度为α,C(OH-)=Cα,
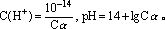
(3)两强碱混合
由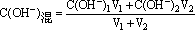 ,先求出混合后的C(OH-),再通过KW求混合后C(H+),最后求pH。
,先求出混合后的C(OH-),再通过KW求混合后C(H+),最后求pH。
3、强酸与强碱混合
先依据H++OH-=H2O,判断是否有过量的情况,可以分为下面三种情况:
(1)若恰好中和,在25℃时,pH=7;
(2)若酸过量,先求出中和后的剩余C(H+),再求pH;
(3)若碱过量,先求中和后剩余的C(OH-),再通过KW求C(H+),最后求pH。
(二)、同一溶液中的pH和pOH的关系
定义pOH=-lg{C(OH-)}
由C(H+)·C(OH-)=Kw,推出在25℃时:
pH+pOH=14