(一)复习要点阐述
1、知识内在联系
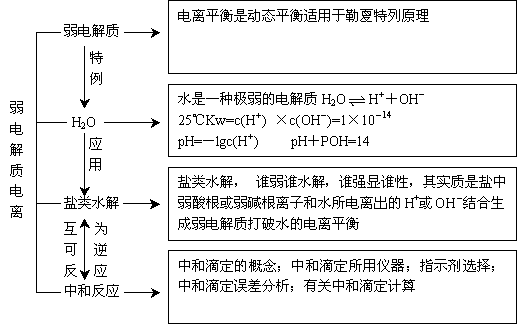
2、强弱电解质与结构的关系
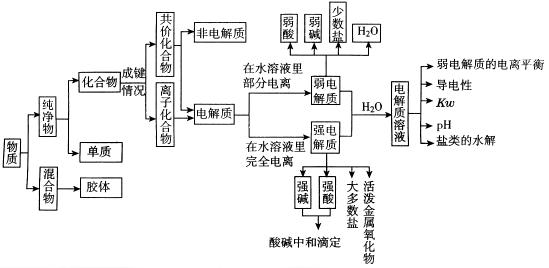
(二)要点复习的策略及技巧
1、电离平衡
(1)电解质与非电解质
什么叫电解质?什么叫非电解质?什么叫强、弱电解质?
凡是在水溶液里或熔化状态下能够导电的化合物叫电解质.在上述情况下不能导电的化合物叫非电解质.
练1、就下列物质:①NaCl晶体 ②乙醇 ③乙酸 ④氨水 ⑤盐酸 ⑥石墨 ⑦苛性钠 ⑧金属铜 ⑨蔗糖 ⑩BaSO4 ⑾SO2
回答下列问题,将相应物质序号填入空白中:
(1)能导电的物质有:④⑤⑥⑧
(2)属于电解质的有:①③④⑤⑦⑩
(3)属于非电解质的有:②⑨⑾
(4)属于强电解质的有:①⑤⑦⑩
(5)属于弱电解质的有:③④
练2、从物质结构的角度来看化学键与强弱电解质有什么关系?

CH3COOH 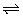 CH3COO-(aq) + H+(aq)
CH3COO-(aq) + H+(aq)
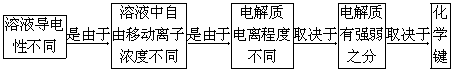
(2)弱电解质的电离平衡
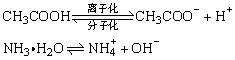
结论:这种具有极性键的化合物在水溶液中的电离过程是可逆的,其水溶液中既有离子又有分子.

练3、下列事实能用勒夏特列原理解释的是( )
A.CaCO3难溶于水却易溶于酸
B.冰镇啤酒倒入烧杯中产生大量泡沫
C.室温时饱和CO2水溶液冷却至0℃时逸出CO2
D.在3%的H2O2溶液中加入少量MnO2放出气泡速率加快
2、水的电离和溶液的pH
(1)水是极弱的电解质
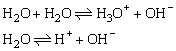
(2)25℃水的离子积公式的推导
练4、精确实验表明25℃纯水中c(H+)=c(OH)-,求25℃水的电离度α和水的电离平衡常数Ka.
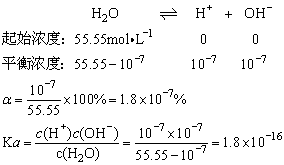
c(H+)c(OH-)=1.8×10-16c(H2O)
因常数乘以常数等于一个新的常数,令新常数为Kw故有:
Kw=c(H+)c(OH-)=1×10-14
(3)Kw的物理意义
在稀酸或稀碱溶液中H+和OH-离子浓度之积在一定温度下为一常数.
(4)溶液的pH值
为什么要引进pH值呢?这是因为当溶液中c(H+)很小时,用物质的量的浓度来表示溶液的酸碱性很不方便.用pH值来表示则很方便,其数学表达式为:pH=-lg c(H+)
(5)溶液的酸碱性

(6)关于溶液pH的计算
①溶液的稀释规律
a.对于强酸溶液c(H+)每稀释10n倍,pH增大n个单位(增大后不超过7).
b.对于强碱溶液c(OH-)每稀释10n倍,pH减小n个单位(减小后不小于7).
c.
对于pH相同的强酸与弱酸(或强碱与弱碱)稀释相同倍数时,pH变化不同,其结果是强酸或强碱的变化程度大,弱酸或弱碱变化的程度小。
②有关溶液pH的计算
a.两种强酸溶液混合,先求c(H+),再求pH.
b.两种强碱溶液混合,先求c(OH-),再根据KW求出c(H+),最后求pH.
c.强酸强碱溶液混合,若恰好完全反应则pH=7,若酸过量,则先求c(H+),后求pH,若碱过量,则先求c(OH-),后求c(H+),再求pH.
3、盐类的水解
(1)盐类水解的概念及实质
①概念:在水溶液中盐电离出来的弱离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解.
②实质:盐中的弱离子和水所电离出的H+或OH-结合生成弱电解质,打破了水的电离平衡,从而使溶液呈现出酸性或碱性.

(2)盐类水解的特点及类型
①盐类水解一般进行的程度较小,其规律可总结为:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,两强显中性.
②盐类水解的类型
a.强酸弱碱盐水解,溶液显酸性,pH<7.如NH4Cl、AlCl3、FeCl3、CuSO4等.
b.强碱弱酸盐水解,溶液显碱性,pH>7.如CH3COONa、Na2CO3、Na2S等.
c.强酸强碱盐不水解,溶液显中性pH=7.如KCl、NaCl、Na2SO4等.
d.弱酸弱碱盐强烈水解,水解后溶液的酸碱性由对应的弱酸弱碱的相对强弱决定,如CH3COONH4强烈水解由于CH3COOH和氨水电离程度几乎相等故水溶液显中性等。
e.多元弱酸酸式盐水解,溶液的酸碱性取决于酸根离子的电离程度和水解程度的相对大小.
甲.若电离程度大于水解程度,溶液呈酸性,如NaHSO3、NaH2PO4等.
乙.若电离程度小于水解程度,溶液呈碱性,如NaHCO3、Na2HPO4等.
(3)盐类水解离子方程式的书写规则
①一般来说,盐类水解不能进行到底,故写作“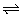 ”.
”.
②盐类水解程度较小,故挥发性的酸和难溶碱不标“↑”或“↓”符号.
③多元弱酸根分步水解,如:
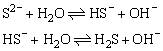
④多元弱碱根阳离子水解可一步写出,如:
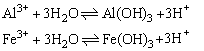
(4)影响盐类水解的因素
①内因:盐类水解程度的大小,主要由盐的本性所决定.
②外因:
a.温度:盐类的水解是吸热反应,因此升高温度能促进盐类的水解.
b.浓度:盐溶液浓度越稀越有利于水解.
c.溶液的酸碱性:水解平衡是化学平衡的一种,外加酸碱能促进或抑制盐的水解.
练5、将下列盐溶液蒸干灼烧(温度不超过500℃)得到的固体残渣是什么?
(1)Na2CO3溶液 (2)AlCl3溶液
(3)Al2(SO4)3溶液 (4)FeCl3溶液
(5)Na2BeO2溶液 (6)BeCl2溶液
答案:
(1)Na2CO3 (2)Al2O3 (3)Al2(SO4)3 (4)Fe2O3 (5)Na2BeO2 (6)BeO
练6、实验室怎样配制下列透明澄清的溶液.
(1)AgNO3溶液
(2)FeCl3溶液
答案:
(1)在配制好的AgNO3溶液中滴加2~3滴浓HNO3;
(2)在配制好的FeCl2溶液中滴加2~3滴浓HCl;
(4)盐类的双水解
一种盐的水溶液显酸性,另一种盐的水溶液显碱性,两者混合生成沉淀放出气体的反应叫双水解.
练7、下列9组盐的水溶液混合时,指出实验现象并写出反应的离子方程式:
(1)Al2(SO4)3和Na2CO3
(2)Al2(SO4)3和NaHCO3
(3)Al2(SO4)3和Na2S
(4)Al2(SO4)3和NaAlO2
(5)FeCl3和Na2CO3
(6)FeCl3和NaHCO3
(7)向FeCl3溶液中滴入1~2滴Na2S溶液
(8)向Na2S溶液中滴入1~2滴FeCl3溶液
(9)ZnCl2和Na2S
答案:
(1)生成沉淀放出气体;2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
(2)生成沉淀放出气体;Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3)生成沉淀放出气体;2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(4)生成沉淀:Al3++3AlO2-+6H2O=4Al(OH)3↓
(5)生成红褐色沉淀放出气体:2Fe3++3CO32-+3H2O=2Fe(OH)3+3CO2↑
(6)生成红褐色沉淀放出气体:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
(7)淡黄色沉淀:2Fe3++S2-=2Fe2++S↓
(8)先出现淡黄色浑浊后出现黑色沉淀:
2Fe3++S2-=2Fe2++S Fe2++S2-=FeS↓
(9)白色沉淀:Zn2++S2-=ZnS↓
结论:一种盐的水溶液显酸性,另一种盐的水溶液显碱性,两者混合可能发生双水解反应,也可能发生复分解反应,还可能发生氧化还原反应.
6、解读“三大守恒”
(1)电荷守恒
在电解质溶液中,阳离子所带正电荷总数恒等于阴离子所带负电荷总数.
例 在1L 0.10mol·L-1 Na2S溶液中:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
(2)物料守恒:所谓物料守恒是指:(1)含特定元素的微粒(例如离子或分子)守恒;(2)不同元素间所形成的特定微粒比守恒;(3)特定微粒的来源关系守恒.
现以1L 0.1mol·L-1 Na2S溶液为例说明物料守恒:
①由S元素守恒有:c(S2-)+c(HS-)+c(H2S)=0.1mol·L-1
②由Na2S特定关系守恒有:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)=0.2mol·L-1
(3)质子守恒:
这里所说的质子守恒是指由水电离出的质子(H+)是一不变的定值.现解读如下:
在纯水中:c(H+)=c(OH-)
当在纯水中加入Na2S配成0.1mol·L-1 Na2S溶液后由于: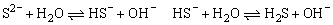 导致上述溶液显碱性:c(OH-)>c(H+),但溶液中n(H+)=n(OH-),对于同一溶液而言可理解为:c(OH-)=c(H+),这里c(OH-)、c(H+)均来自于水的电离,而水电离出的n(H+),由如下三部分组成:
导致上述溶液显碱性:c(OH-)>c(H+),但溶液中n(H+)=n(OH-),对于同一溶液而言可理解为:c(OH-)=c(H+),这里c(OH-)、c(H+)均来自于水的电离,而水电离出的n(H+),由如下三部分组成:
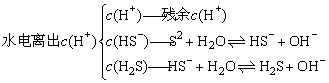
在0.1mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
4、酸碱中和滴定
(1)什么叫酸滴定碱?什么叫碱滴定酸?
用已知物质的量浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法.
(2)酸碱中和滴定的原理是什么?
练8、用0.1032mol·L-1 HCl溶液滴定25.00mL未知浓度的NaOH溶液,滴定完成时用去标准酸27.84mL求待测NaOH溶液物质的量浓度.
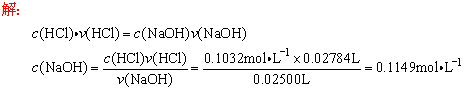
(3)中和滴定要用到哪些仪器?
酸式(或碱式)滴定管、锥形瓶、铁架台、滴定管夹、容量瓶
滴定管使用规则:
①滴定管使用前必须检查是否漏水。实验室还有哪些仪器在使用前必须查漏呢?(容器瓶、分液漏斗、滴定管)查漏后用蒸馏水洗净后再用标准酸或标准碱(或待测碱或酸)润洗2~3次.
②酸式滴定管不能盛装碱溶液,碱式滴定管不能盛装酸或强氧化性溶液例如酸性KMnO4溶液.
③滴定管读数
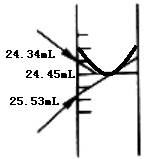
由于滴定管的刻度是“上小下大”,所以俯视时读数小于正确值,仰视时读数大于正确值。
练9、在一支25.00mL酸式滴定管中,盛标准酸的液面最低处与在5.00mL刻度相平,若把滴定管中标准酸全部倒出体积应是:
A.大于20mL B.小于20mL
C.20ml D.5mL
答:滴定管“0”刻度在上且尖嘴部分未计入刻度内故选A。
读数应注意:(1)读数时,滴定管应垂直于地面;
(2)读数时应读至小数点后第2位.
(4)中和滴定时应怎样选择指示剂?
一般要求变色明显(所以一般不选用石蕊),指示剂的变化范围与恰好中和时的pH要吻合.
强酸强碱相互滴定,生成的盐不水解,呈中性,可用酚酞或甲基橙作指示剂.
(5)中和滴定操作
Ⅰ.准备:
①滴定管
a.检查滴定管是否漏水;
b.滴定管用蒸馏水洗净后用标准液或待测液润洗2—3次,并排除尖嘴部分的气泡;
c.用漏斗注入标准液至“0”刻度上方2~3 cm处;
d.将液面调节到“0”刻度(或“0”刻度以下某一刻度)记下刻度.
②锥形瓶:只用蒸馏水洗涤,不能用待测液润洗.
③移液管:转移少量溶液用,其洗涤方法与滴定管相同.
Ⅱ.滴定:
①用移液管(或滴定管)取一定体积待测液于锥形瓶中,滴入2~3滴指示剂.
②用左手握活塞旋转开关缓缓滴入液体,右手不断旋转振荡锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,当滴下一滴颜色突变时,记下刻度.
Ⅲ.计算:
每个样品滴定2~3次,取平均值求出结果.
注意:①滴定管“0”刻度线在上面,全部容积大于其最大刻度值,属于精量仪器.
②酸、碱式滴定管、移液管在清洗干净后必须用待装液润洗方能使用,而锥形瓶在清洗干净后不能用待装液润洗.
例1、c(H+)相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液中c(H+)仍相同,则m和n的关系是( )
A.m>n B.m=n
C.m<n D.不能确定
解析:
因醋酸是弱电解质,当c(H+)相同的醋酸与盐酸被稀释相同的倍数时,由于醋酸分子又能继续电离出H+,而使c(H+)降低得显然要比盐酸“慢”,故应加多一些水使醋酸中的c(H+)和盐酸相同.
答案:A
例2、25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是( )
A.该溶液的pH一定是9
B.该溶液pH可能为5
C.该溶液的pH不可能是7
D.不会有这样的溶液
解析:
此溶液中c(H+)水=c(OH-)水=1×10-9<1×10-7,显然水的电离平衡受到了抑制,故该溶液可能为酸溶液或碱溶液,pH可能为5或9,而不可能为7,因此选BC.
答案:BC
例3、下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
解析:
由质子守恒知0.1mol·L-1 Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),A对;由电荷守恒知0.1mol·L-1 NH4Cl溶液中:c(H+)+c(NH4+)=c(OH-)+c(Cl-)因溶液显酸性易知c(H+)>c(OH-)可推出c(NH4+)<c(Cl-),B错;由于CH3COONa和CH3COOH组成的混合液中c(H+)>c(OH-),由电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C错;由于NaNO3不水解故NaNO3不论在酸性溶液中还是碱性溶液中c(Na+)=c(NO3-),D对.
答案:AD
例4、在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.C(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.C(CH3COO-)>c(Na+)>c(H+)>c(OH-)
解析:
pH=11的NaOH溶液中c(OH-)=10-3mol·L-1,pH=3的CH3COOH溶液中c(CH3COOH)>10-3mol·L-1易知两者等体积混和后得到的CH3COONa和CH3COOH组成的混和液溶液显酸性,溶液中各种离子浓度的大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)知D对B、C错.由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因c(H+)>c(OH-),所以c(CH3COO-)>c(Na+).
例5、草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=1×10-2mol/L
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D.V(NaOH)>10mL时,c(Na+)>C(C2O42-)>c(HC2O4-)
解析:
n(NaHC2O4)=0.01mol·L-1×10-2L=10-4mol,由NaHC2O4+NaOH=Na2C2O4+H2O知当向10mL 0.01mol·L-1 NaHC2O4溶液中滴入0.01mol·L-1 NaOH溶液10mL时,两者恰好完全反应生成Na2C2O4,由于Na2C2O4水解显碱性易知反应后溶液中c(H+)<10-7mol·L-1,C错;当v(NaOH)>10mL时,NaOH过量溶液中离子浓度大小为:c(Na+)>c(C2O42-)>c(HC2O4-),D对.
当v(NaOH)=0mL时溶液中仅存HC2O4-,由HC2O4- H++C2O42-知当v(NaOH)=0时溶液中0.01mol·L-1, HC2O4-在溶液中电离出的c(H+)<10-2mol·L-1,A错;当v(NaOH)<10mL时,由电荷守恒知c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-) ……①,当v(NaOH)<10mL时即滴定过程中HC2O4-尚未完全中和某一时刻溶液中一定存在c(H+)=c(OH-)……②,将②式代入①式得:c(Na+)=2c(C2O42-)+c(HC2O4-)知B错.
H++C2O42-知当v(NaOH)=0时溶液中0.01mol·L-1, HC2O4-在溶液中电离出的c(H+)<10-2mol·L-1,A错;当v(NaOH)<10mL时,由电荷守恒知c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-) ……①,当v(NaOH)<10mL时即滴定过程中HC2O4-尚未完全中和某一时刻溶液中一定存在c(H+)=c(OH-)……②,将②式代入①式得:c(Na+)=2c(C2O42-)+c(HC2O4-)知B错.
答案:D
例6、室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应.下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7

例7、某温度(t℃)时,水的KW=1×10-13,则该温度__________(填“大于”“小于”或“等于”)25℃,其理由是_____________________________________________________.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合:
(1)若所得混合溶液为中性,则a︰b=________.
(2)若所得混合液的pH=2,则a︰b=________.
(3)若所得混合液的pH=10,则a︰b=________.
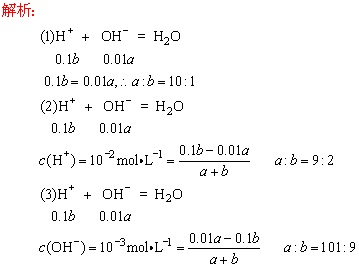
答案:大于 升高温度可促进水的电离
(1)10︰1 (2)9︰2 (3)101︰9
例8、某二元弱酸(简写为H2A)按下式发生一级电离、二级电离:

已知相同浓度时,H2A比HA-电离程度大.设有下列四种溶液:A.0.01mol·L-1 H2A溶液;B.0.01mol·L-1 NaHA溶液;C.0.02mol·L-1 HCl与0.04mol·L-1的NaHA溶液等体积混合;D.0.02mol·L-1 NaOH溶液与0.02mol·L-1 NaHA溶液等体积混合,据此填写下列空白:
(1)c(H+)最大的是__________,最小的是__________.
(2)c(H2A)最大的是__________,最小的是__________.
(3)c(A2-)最大的是__________,最小的是__________.
解析:
A:0.01mol·L-1 H2A溶液;
B:0.01mol·L-1 NaHA溶液;
C:HCl + NaHA = NaCl + H2A
0.02 0.04 0.02
因等体积混和,故溶液中:
c(H2A)=0.01mol·L-1;c(NaHA)=0.01mol
D:NaOH + NaHA = Na2A + H2O
0.02 0.02 0.02
因等体积混和,故溶液中:c(Na2A)=0.01mol·L-1
(1)对溶液A来说 c(H+)取决于H2A的一级电离,对于溶液B来说 c(H+)取决于HA-二级电离,因A、B溶液物质的量浓度相等,所以A中c(H+)>B中c(H+).而C中虽然c(H2A)=0.01mol·L-1,由于:NaHA=Na++HA-,HA-存在抑制了H2A的一级电离,故A中c(H+)>C中c(H+).
因D中Na2A是强碱弱酸盐因其水解而水溶液显碱性而A、B、C三选项所到溶液均显酸性,所以D中c(H+)最小.
(2)由于C中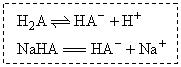 ,而A中H2A
,而A中H2A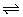 HA-+H+,所以C中c(H2A)最大, D中c(H2A)最小.
HA-+H+,所以C中c(H2A)最大, D中c(H2A)最小.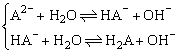 .
.
(3)因D中为0.01mol·L-1 Na2A,所以D中c(A2-)最大,A中: 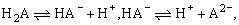 A中c(A2-)最小.
A中c(A2-)最小.
答案:
(1)A; D (2)C; D (3)D; A