|
我国现行高考的主要目的是从水平相近的合格高中毕业生中挑选出高等学校的最佳人选。显然高考不是水平考试而是选拔考试,是竞争考试,既然存在着竞争,必然有被淘汰者,要使学生在高考中取得较好的成绩,除必须提高能力之外还得在考试中掌握如下应考技巧,当然应考技巧也是一种能力。
应考技巧包括两个方面:心态调整和答题技巧。
一、考前心态调整
1、考试焦虑
大多数考生临近考试时会有不同程度的紧张,当紧张过度成为焦虑时,就成了一种消极的情绪体验,所以许多考生一到关键性考试前夕就有心神不定、长夜失眠、注意力不集中等表现。一旦进入考场,便觉得神志不清,思维停滞,有的连平常很熟练简单的知识也回忆不起,有的老半天写不出一个字,严重的还会当场昏倒。
2、心理定势
影响考试的心理定势主要有两个方面,一是习惯定势,二是思维定势。如考试时碰到与平时练习相似或相近的题目,有的考生就会非常高兴,因而不再仔细审题就匆匆下笔,造成许多非知识性失分。
3、瓶颈效应
瓶颈效应是指在考试过程中,心里觉得似乎容易解决而一时又解决不了的心理现象。这时考生答题一会儿感到似乎已经茅塞顿开,一会儿又觉得毫无办法,欲行不能,欲罢不忍,时间不知不觉溜过去了。
4、自暴自弃
有的考生遇到连续几个题做不出来时,立即紧张起来。而情绪一紧张,思路就展不开,觉得整卷题目可能都是难题,于是抱着“反正做不出”的心理破罐破摔。
5、过分自信
这类考生与第四种考生刚好相反,他们在顺利完成几道题后,开始沾沾自喜,继续答题时粗心大意,不求精确,导致思维缺乏严密性,答好题后也不进行认真检查。
以上这些心理因素反映出的非正常情绪状态会导致考试失分,需要采取有效的措施来调适,常用的措施有:
措施一:“心中有佛,眼中有佛”
坚信“我行,我能考好”。信心是高考成功的精神支柱,高考中有没有必胜的信心,取决于能否正确对待自己的考试目标,能否把自己的水平正常发挥出来。
有一点非常重要,就是考生一定不能迷信,有的考生考前看到了乌鸦,就觉得自己完了,看到喜鹊则认定对自己是个好兆头。还有许多考生考前爱扔硬币来判定自己的成功几率。这些都是要不得的,只会扰乱你的情绪,打击你的自信。
措施二:“无为而无不为”
老子讲:“无为而无不为”准确地说应是:“无妄为而无不为”。这里敢“妄为”是指不切实际的奋斗目标。这句用现代话来说就是:“只有你的奋斗目标定位准确,切合你的实际就没有不成功的,就没有办不成的事。”
考生要学会正确地评估自己,避免过分自卑和盲目自信:成绩优秀、性格外向的考生应多想自己的不足,而成绩不良、性格内向的考生也应看到自己的长处,树立考试信心。考生应该明白,个体之间的差别是客观存在的,重要的是要根据自己的实际,发挥长处,考出最好水平。
二、高考答题技巧
1、信心十足进考场——先入为主
当高考试卷发下来之后,尽量不去想象它的难度或是否有自己见过的熟题,而是立即投入到答题的思维之中去。如果先浏览一遍试卷,势必产生私心杂念,不能静下来全力思考,遇见陌生题型往往心慌意乱,未上阵己先输一着。“我不会做的题别人也不会”,只要这样想才能迅速使自己冷静下来。遇到自己所熟悉的题型又忘乎所以,必然“大意失荆州”。所以应循序渐进,顺序答题越做越顺手可谓居高临下,势如破竹。
2、“异中求同”——生题熟作
新情景试题是近年来国家考试中心新开发出的一种新题型,其功效就是引导考生跳出题海,避免狎题、猜题,以减轻学生负担,推进素质教育。这种题型的最大优点是它通常以最新的科技成果为素材。例如以当年诺贝尔奖得主的研究成果为命题素材考查中学课本中的基础知识,基本概念。这类题目具有:“起点高,落点低”的特点,它使每个考生都处于同一起跑线上,但处于同一起跑线上的考生有的表现为兴奋,有的压抑,有的紧张,因此解答新情景试题要运用“异中求同”的方法。“新情景”是异,但它考查的知识点一定源于中学课本,这就是同,因此尽可能将这种没有见过的新题纳入“平时训练过的某题的框架中来解”,这就是“异中求同”。
有时有的科目高考试题把一些解题程序繁琐,计算难度较大,较枯燥,给分又不多的题摆在前面,也可能一开卷遇到的题就是你所忽视的题,怎么办?不要紧,跳过去“别理它,烦着呢!”待心不烦,气也顺的时候再来各个击破。
当你顺利地解答了几道题之后,心理状态便稳定了,精力也就投入进去了,坚信“每临大事有静气,不信今人无古贤”。再回过头来解答这类题目,你更发现它是唬人的。否则一耽误时间、二信心也垮下来了。
3、“同中求异”——熟题生作
答题时要考虑全面,思路要打开,应遵循如下两原则:①异中求同——碰到未见过的题型,采取生题熟做的原则,即将新的未见过的信息通过知识迁移找出自己熟悉的解题途径。②同中求异——遇见训练过的题型,要熟题生做,注意分析题给信息,要求的是什么?是否设有“陷井”?
4、能得高分争满分——能得1分不丢分
近年来高考命题呈现的趋势是变以前的一题压轴为题题把关,因此命题特点是:动手容易深入难,得分容易得满分难。根据高考命题的这一特点应采取的策略是:
在解答试题时可以允许战术上失败,可以允许局部失败,须知局部的失败,战术上的失败就是为了赢得战略上的胜利,确保全局的胜利。
遇到分值不菲,但估计自己能力不可能达到的拉距离的题,要舍得丢车保帅,把主要精力放在基础题和中档题上,以稳定得分的大局。
5、惜时如金——争分夺秒
高考时一定要把握好时间,做到惜时如金,争分夺秒,做题时能得高分争满分,能得1分不丢分,惜时如金,但切不可频频看表。
6、孤注一掷——切忌空题
解题时一旦思路消失,可能心慌意乱,此时一定要强迫自己的注意力集中,不要自暴自弃,对于个别有思路无把握的计算题,尽力振笔疾书,能写多少写多少,不要考虑正确与否,会多少答多少碰碰运气。
三、怎样选择题
1、化繁为简的电子守恒法
例1、足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
解析:
设有n(Cu)mol铜失电子,使一定量HNO3还原成NO2、N2O4、NO这一过程得失电子是守恒的,而后的过程即1.68L(标准状况下)O2,即 O2得电子将上述NO2、N2O4、NO又氧化成HNO3这一过程中得失电子也是守恒的,故有: O2得电子将上述NO2、N2O4、NO又氧化成HNO3这一过程中得失电子也是守恒的,故有: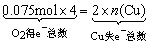 ,n(Cu)=0.15mol。 ,n(Cu)=0.15mol。
由Cu2++2OH-=Cu(OH)2↓知v(NaOH)=  。 。
答案:A
例2、在热酸性溶液中,2.53g KNO3恰好能氧化9.52g FeCl2,试推断硝酸钾的还原产物是( )
A.KNO2 B.NO
C.NO2 D.N2O
解析:
设x为KNO3中+5价的氮元素下降的价数,由电子得失守恒有: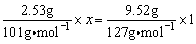 ,解之得:x=3,故KNO3的还原产物为NO。 ,解之得:x=3,故KNO3的还原产物为NO。
答案:B
例3、向VmLFeBr2溶液中缓慢通入a mol Cl2,结果溶液中50%的Br-被氧化成Br2,则原溶液中FeBr2的物质的量浓度为( )
A. mol·L-1 B. mol·L-1 B. mol·L-1 mol·L-1
C. mol·L-1 D. mol·L-1 D.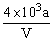 mol·L-1 mol·L-1
解析:
设FeBr2为x mol,则由电子得失守恒有:
2a=x+2x×50%
a=x
c(FeBr2)= 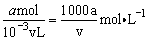 。 。
答案:A
2、出奇制胜的极限法
例4、在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
解析:
若生成物全部是Na2O,则:m(Na2O)=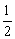 ×0.04mol×62g·mol-1=1.24g。 ×0.04mol×62g·mol-1=1.24g。
若生成物全部是Na2O2,则:m(Na2O2)=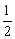 ×0.04mol×78g·mol-1=1.56g。 ×0.04mol×78g·mol-1=1.56g。
现生成物质量为1.5g介于两者之间可知生成物为Na2O和Na2O2组成的混合物。
答案:C
例5、0.2mol KMnO4在一定温度下加热生成a mol O2,将剩余的固体与浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在.若a+b=m,则m的值可能是( )
A.0.35 B.0.45
C.0.55 D.0.60
解析:
由KMnO4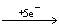 Mn2+得电子总数0.2mol×5=1.0mol,共失电子总数为: Mn2+得电子总数0.2mol×5=1.0mol,共失电子总数为:
4a + 2b = 1.0mol,即有:
(生成O2得e-数) (生成Cl2失e-数)
2a+b=0.5mol变形为a+b=0.5-a ①
设题给0.2mol KMnO4完全分解,则生成n(O2)极大值为0.1mol,
即:0<a≤0.1 ②
将②式代入①式有:
0.4<a+b<0.5。
答案:B
3、“三大守恒”解选择题
例6、下列叙述正确的是( )
A.0.1 mol·L-1氨水中,c(OH-)=c(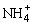 ) )
B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
解析:
根据电荷守恒可知:A中有下列等式成立c(H+)+c(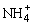 )=c(OH-),故c(OH-)>c( )=c(OH-),故c(OH-)>c(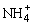 ),A不正确;B中二者充分混合后剩余OH-的物质的量为:1 ),A不正确;B中二者充分混合后剩余OH-的物质的量为:1 0×10-3L×0.02 mol·L-1×2-10×10-3L×0.02 mol·L-1=2×10-4mol,c(OH-)= 0×10-3L×0.02 mol·L-1×2-10×10-3L×0.02 mol·L-1=2×10-4mol,c(OH-)=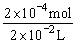 = =
10-2mol·L-1,pH=12,B正确;C选项:在水中c(OH-)=c(H+)加入CH3COONa后:CH3COO-+H2O CH3COOH+OH-,由质子守恒知:c(OH-)=c(H+)+c(CH3COOH)。 CH3COOH+OH-,由质子守恒知:c(OH-)=c(H+)+c(CH3COOH)。
可知C选项正确;由物料守恒即溶液中含Na元素的离子浓度之和应该等于所有含A元素离子浓度之和有:c(Na+)=c(HA-)+c(H2A),D不正确。
答案:BC
例7、在Na2S溶液中存在的下列关系中不正确的是( )
A.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
B.c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.c(Na+)>c(S2-)>c(OH-)>c(HS-)
解析:
在Na2S溶液中,c(Na+)=2c(S2-)。因S2-+H2O HS-+OH-, HS-+OH-,
HS-+H2O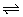 H2S+OH-。由物料守恒知:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),A正确,不合题意。由电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),B不正确,B选项合题意。在水中:c(H+)=c(OH-),但加入Na2S后,因S2-+H2O H2S+OH-。由物料守恒知:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),A正确,不合题意。由电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),B不正确,B选项合题意。在水中:c(H+)=c(OH-),但加入Na2S后,因S2-+H2O HS-+ HS-+
OH-,HS-+H2O H2S+OH-。由质子守恒知:c(OH-)=c(H+)+c(HS-)+2c(H2S),C正确,不合题意。由Na2S水溶液呈碱性,故Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-),D正确,不合题意。 H2S+OH-。由质子守恒知:c(OH-)=c(H+)+c(HS-)+2c(H2S),C正确,不合题意。由Na2S水溶液呈碱性,故Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-),D正确,不合题意。
答案:B
4、图象选择题
例8、对于可逆反应:3A(g)+B(g) 2c(g)在其它条件不变时改变某一条件,对化学平衡的影响得到如下变化规律,分析下图,下列结论正确的是( ) 2c(g)在其它条件不变时改变某一条件,对化学平衡的影响得到如下变化规律,分析下图,下列结论正确的是( )
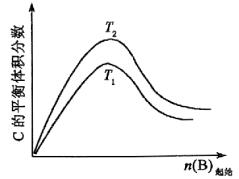
A.△H<0,T2>T1;或△H>0,T2<T1
B.△H>0,T2>T1;或△H<0,T2>T1
C.△H>0,T2<T1;或△H<0,T2>T1
D.△H>0,T2>T1;或△H<0,T2<T1
解析:
尽管温度T1、T2的高低不能确定,但只有如下两种情况:(1)若T2>T1,由图象知,温度越高,C在平衡混和物中体积分数越大,则正反应吸热,所以△H>0,结论:T2>T1,△H>0;(2)若T1>T2,由图象知温度越高,C在平衡混和物中体积分数越小,故正反应放热,△H<0,结论:T1>T2,△H<0,D选项正确。
答案:D
例9、往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示,则原溶液中c(I-)/c(Cl-)的比值为( )
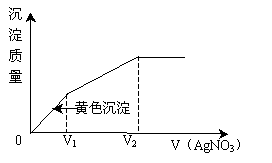
A.(V2-V1)/V1 B.V1/V2
C.V1(V2-V1) D.V2/V1
解析:
由于AgI在水中的溶解度比AgBr小,故滴入AgNO3溶液后先生成AgI,待I-沉淀完全后再生成AgBr。由图象知生成AgI黄色沉淀耗AgNO3溶液体积为V,生成AgBr沉淀消耗AgNO3溶液体积为(V2-V1)。所以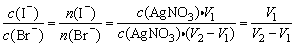 ,C正确。 ,C正确。
5、记忆背诵——快速解选择题
例10、X、Y为短周期元素,X位于I A族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1︰1
D.X2Y可能是离子化合物,也可能是共价化合物
解析:
由题意知X为I A,Y为ⅥA,X2Y可能是H2O、Na2O、Na2S等化合物,故A、B错误。Na与O可形成Na2O2,H与O可形成H2O2化合物,C错误,D正确。可能是离子化合物Na2O、Na2S,也可以是共价化合物H2O。
答案:D
例11、同主族两种元素原子的核外电子数的差值可能为( )
A.6 B.12
C.26 D.30
解析:
二、三周期各8种元素,四、五周期各18种元素,六周期32种元素,七周期22种元素,因此相邻同A族元素原子核外电子数之差即为原子序数之差,依次可能为2、8、18、32,若同主族元素间隔1个周期、2个周期、3个周期,则原子核外电子数之差可能为10(11Na和1H)、26(37Rb和11Na)、36(35Cs和19K)、44(55Cs和11Na),故C正确。
答案:C
6、热化学方程式常考常新
例12、已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中l mol H—H键断裂时吸收热量为( )
A.920 kJ B.557kJ
C.436 kJ D.188 kJ
解析:
设1molH—H键断裂时吸收热量为QkJ,则由∑(反应物键能之和)—∑(生成物键能之和)=2Q+496kJ-2×2×463kJ=-2×2×121kJ。
答案:C
例13、下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)=CO2(g);△H1 C(s)+ O2(g)=CO(g);△H2 O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+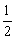 O2(g)=H2O(l);△H5 2H2(g)+O2(g)=2H2O(l);△H6 O2(g)=H2O(l);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.① B.④
C.②③④ D.①②③
解析:
△H大小的比较遵循如下规律:①吸热反应的△H>0,放热反应的△H<0,所以吸热反应的△H>放热反应的△H;②放热反应的△H只须比较绝对值的大小,绝对值小的△H大,绝对值大的△H小。
答案:C
7、立足基础解有机选择题
例14、胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;④1 mol该化合物最多可与2 mol Br2发生反应。其中正确的是( )
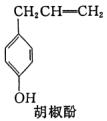
A.①③ B.①②④
C.②③ D.②③④
解析:
由仅由C、H两元素组成的化合物叫烃知①错;可将胡椒酚分子看作是由CH2=CHCH2—取代 分子结构中羟基对位上的H原子,而生成的衍生物,因苯环上6个H和6个C共平面,据此可知胡椒酚分子结构中至少有7个C共面。由于其分子结构中含—CH2—,故胡椒酚分子结构中取代基CH2=CHCH2—中2个C和甲苯酚基中的7个C可能共面也可能不共面,因此②错;苯环上的酚羟基可异构成醛基: 分子结构中羟基对位上的H原子,而生成的衍生物,因苯环上6个H和6个C共平面,据此可知胡椒酚分子结构中至少有7个C共面。由于其分子结构中含—CH2—,故胡椒酚分子结构中取代基CH2=CHCH2—中2个C和甲苯酚基中的7个C可能共面也可能不共面,因此②错;苯环上的酚羟基可异构成醛基: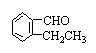 ,故③对;1mol胡椒酚最多能和3mol Br2反应,其中1mol Br2发生加成反应2mol Br2发生取代反应。 ,故③对;1mol胡椒酚最多能和3mol Br2反应,其中1mol Br2发生加成反应2mol Br2发生取代反应。
答案:C
例15、咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示:
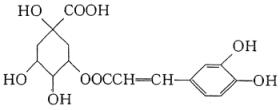
关于咖啡鞣酸的下列叙述不正确的是( )
A.分子式为C16H18O9
B.与苯环直接相连的原子都在同一平面上
C.1mol咖啡鞣酸水解时可消耗8 mol NaOH
D.与浓溴水既能发生取代反应又能发生加成反应
解析:
由题目所给的结构简式易知其分子式为C16H18O9,A正确;由苯分子中所有原子都处于同一平面的结构可知,与苯环直接相连的所有原子共面,则B正确;1 mol咖啡鞣酸水解产生1mol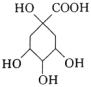 和1mol 和1mol ,除—COOH可消耗NaOH外,酚羟基可消耗NaOH,故1 mol咖啡鞣酸水解,可消耗4 mol NaOH,C不正确;所给物质的分子中既含—CH=CH—官能团易知能与Br2发生加成反应,又含酚结构故能和溴水发生取代反应,故D选项正确。 ,除—COOH可消耗NaOH外,酚羟基可消耗NaOH,故1 mol咖啡鞣酸水解,可消耗4 mol NaOH,C不正确;所给物质的分子中既含—CH=CH—官能团易知能与Br2发生加成反应,又含酚结构故能和溴水发生取代反应,故D选项正确。
四、怎样解无机框图题
任何一道无机框图题在设计上必然存在着解题的“切入点”,即平常所说的常见的无机推断的突破口。现将一些常见的“无机框图题”解题“突破口”归纳如下:
1、同一元素的气态氢化物和气态氧化物反应,生成该元素的单质和水,该元素可能是硫或氮。
2、同一元素的气态氢化物和最高价氧化物对应的水化物化合生成盐,该元素一定是氮。
3、两溶液混合生成沉淀和气体,这两种溶液的溶质可能分别是:(1)Ba(OH)2与(NH4)2SO4;(2)可溶性盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐;(3)可溶性铝铁盐与可溶性碳酸盐或碳酸氢盐。
4、既能与酸反应,又能与强碱反应的物质可能是Al、Al2O3、Al(OH)3、氨基酸、弱酸的铵盐、弱酸的酸式盐等。
5、既能与强酸反应放出气体又能与强碱反应放出气体,常见的物质有Al、弱酸的铵盐(如碳酸铵、碳酸氢铵、亚硫酸铵、硫化铵、硫氢化铵等)。
6、在水中分解生成气体和难溶物或微溶物的物质可能是Al2S3、Mg3N2、CaC2等。
7、与水接触放出气体的常见物质有:Li、Na、K、Na2O2、F2。
8、A物质放到B物质中,先生成沉淀,后沉淀又溶解,A、B可能分别是CO2与Ca(OH)2、NaOH与铝盐、NH3与AgNO3、HCl与NaAlO2。
9、使溴水褪色的物质有H2S、SO2、不饱和烃类、活泼金属、碱类等。
10、特殊的实验现象
(1)H2在Cl2中燃烧发出苍白色火焰。
(2)钠元素的焰色反应为黄色,钾元素的焰色反应为浅紫色。
(3)遇湿润红色石蕊试纸变蓝的气体必是氨气。
(4)在空气中迅速由无色变为红棕色的气体是NO。
(5)Cl2通入含Br-的溶液中,会出现橙色;加入有机溶剂,在有机溶剂层出现橙色。Cl2通入含有I-的溶液中,会出现深黄色,加入有机溶剂,在有机溶剂层出现紫色。
(6)遇SCN-显红色的离子是Fe3+。
(7)遇BaCl2溶液生成白色沉淀的溶液中可能含有Ag+或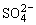 。 。
(8)遇HCl生成沉淀的溶液中可能含有Ag+、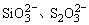 。 。
(9)具有臭鸡蛋气味的气体是H2S,与H2S反应生成淡黄色沉淀的气体可能是Cl2、O2、SO2、NO2等。
(10)电解电解质溶液时阳极气态产物一般是Cl2或O2,阴极气态产物是H2。
(11)使品红褪色的气体可能是Cl2或SO2,物质可能是次氯酸盐[如NaClO、Ca(ClO)2、氯水、Na2O2等。
例16、根据下图所示关系填空,已知所有字母表示的是纯净物或水溶液,反应①、③是工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,H与E相对分子质量之间的关系为Mr(H)—Mr(E)=34,又知C焰色反应火焰呈黄色。

(1)B固体中所包含的化学键有_______;
(2)反应①的化学方程式为_______;反应⑤的离子方程式为_______;
(3)工业上反应③的条件为_______;
(4)在工业上G是如何转化为H的? ______________ (请用文字叙述)。
解析:
解题突破口选择在C焰色反应为黄色,X在常温下为液体,知X为H2O。据此结合框图转化关系推知B为Na2O2,A为FeS2,则全题可解。
答案:
(1)离子键 非极性键
(2)2Na2O2+2H2O=4NaOH+O2↑
Fe3++3OH-=Fe(OH)3↓
(3)400℃~500℃ V2O5
(4)用98.3%浓H2SO4吸收SO3
五、怎样解有机推断题
高考有机试题一般有一道选择题(多为“多官能团”有机物),高考有机题考核的基础主要有如下5点,掌握了如下5点,则有机框图推断题解法就在其中。
1、有机物结构理论要点有哪些?这些理论要点有什么作用?
有机化合物的结构理论要点:
(1)有机化合物中碳元素为4价,分子里的原子,按照它们各自的化合物相互结合,无游离的价键。
(2)碳原子间可以碳碳单键、碳碳双键、碳碳叁键结合,剩余价键为氢原子或其它原子所饱和。
(3)碳碳键可以成链、亦可成环,碳链和碳键决定有机物的性质。
(4)有机物的性质不仅决定于分子组成还决定于分子结构。分子中官能团相互影响。
运用上述有机物结构理论要点可以指导我们书写有机物的结构式、结构简式,书写有机物的同分异构体的结构简式、解释有机物的同分异构现象。
2、烷烃的系统命名法有什么规律?
烷烃的系统命名法是有机物系统命名的基础,为方便好记现将课本上介绍的系统命名法要点归纳如下:最长碳链是主链,支链最近是起点,不同基简在前,相同基用二、三。
3、怎样书写烷烃的同分异构体?
烷烃同分异构体书写规则:
(1)写出最长的碳链
(2)将最长碳链上的碳原子依次减少,将减下的碳原子(一个或多个)连在主链上,并依次改变它的位置和连接方式。
(3)碳为四价,剩余价键全部为氢原子所饱和。
4、学会从有机物分子式和分子中的官能团的加加减减中推断有机物的结构。学会有机物通过组合分子碎片的方法来确定同分异构体。
5、注重“取代羧酸”的相关试题的演练,多找些含有苯环、羟基、羧基或酯基的试题做做。羧酸分子中非羧基氢原子被其他原子取代后,可发生的反应及类型很多,常为高考题目的理想选择。以丙酸(CH3CH2COOH)为例,某个H被Cl取代可得CH3CHClCOOH;若—Cl被羟基取代可得乳酸[CH3CH(OH)COOH],乳酸既是羧酸又是醇类,酯化反应可得到链状酯和环酯,环酯水解得到羟基酸,乳酸消去—OH可得CH2=CH—COOH,各类物质取代基种类、位置不同可得多种同分异构体等。
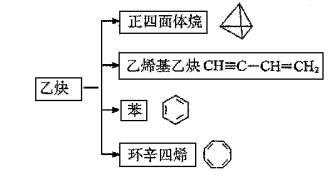
例17、乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)用化学方程式表示以乙炔为原料合成乙烯基乙炔的化学方程式并注明反应类型。
(3)关于乙烯基乙炔分子的说法错误的是________。
a.能使酸性KMnO4溶液褪色
b.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:________
有机物A与环辛四烯互为同分异构体,A不能使溴的四氯化碳溶液褪色,且在室温下为无色晶体,熔点为131℃,分子中每个碳原子都以3个键长相等的单键分别跟其它三个碳原子相连,则A的结构简式为:________,其二氯代物有________种。
(5)环辛四烯能使溴水褪色,写出环辛四烯和溴发生加成反应可能有的化学方程式:________________。
(6)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):________________。
答案:
(1)C4H4;1
(2)CH≡CH+CH≡CH→CH≡C—CH=CH2
(3)d
(4) 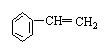 ; ;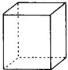 ;3 ;3
(5)  +Br2→ +Br2→
 +Br2→ +Br2→
(6) 
六、怎样解答实验题
根据近年来高考命题趋势来分析高考实验题,有可能将实验无机推断,计算融为一体,这种新题型常使考生解答不“得心应手”,因此在考前应予注意。
例18、已知①②③④均为气体,⑤⑥为固体,它们之间有如下转换关系:

(1)④的电子式是________,④的分子结构是________;
(2)①和②反应的化学方程式:________________;
(3)在下列方框中画出实验室制备④的发生装置示意图与题给装置连成一完整实验装置图,并回答下列问题。
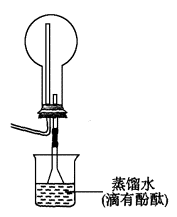
①实验室制备④反应的方程式:________________;
②烧杯中溶液由无色变红色原因是(用电离方程式表示) ________________;
③在图所示的烧瓶中充满气体④,胶头滴管中水挤压2~3滴入烧瓶后观察到的现象是________________,这一现象说明④具有什么性质?________________
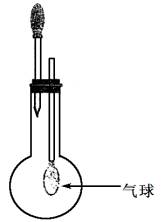
④测得用排空法收集到的一烧瓶NH3的质量是相同状况下相同体积H2质量的10倍,若将该烧瓶中NH3作喷泉实验,实验完毕后,烧瓶中水可上升至烧瓶容积的________(填“几分之几”)
答案:
(1)
 ;三角锥形 ;三角锥形
(2)H2+Cl2 2HCl 2HCl
(3)
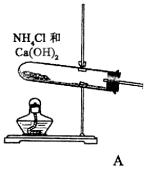
①Ca(OH)2+2NH4Cl CaCl2+2NH3↑+H2O CaCl2+2NH3↑+H2O
②NH3+H2O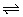 NH3·H2O NH3·H2O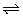  +OH- +OH-
③气球胀大;极易溶于水
④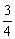
- 返回 -
|