1、复习要点阐述
(1)本专题考点内在联系
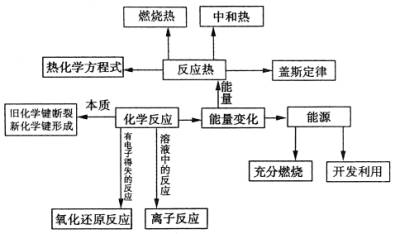
2、要点复习的策略及技巧
氧化还原反应是高考重点之一。
化学《考试大纲》中要求“理解氧化和还原、氧化性和还原性、氧化剂和还原剂等概念。能判断氧化还原反应中电子转移的方向和数目,并能配平氧化还原反应方程式”。由于教材把化学反应中的物质变化和能量变化联系在一起研究,这种编排顺序有利于我们从“质”“能”两方面加深对化学反应本质的理解,即化学反应的过程是反应物分子旧化学键的断裂和生成物新化学键的形成过程,在这一过程中,原子进行重新组合,并且在发生物质变化的同时,必然伴随着能量变化,根据教材这一新的变化预测今后高考试题的命题必然要涉及本部分内容,预测高考命题可能将反应中的物质变化和能量变化结合起来考查氧化还原反应和反应热等基本概念,试题形式可能以选择题、填空题、计算题形式出现。
要点l:氧化还原反应的基本规律
(1)守恒律——化合价升高和降低总数相等,电子得失总数相等。
(2)强弱律——具有较强氧化性的氧化剂跟具有较强还原性的还原剂反应生成具有较弱还原性的还原产物和具有较弱氧化性的氧化产物。
(3)价态律——元素处于最高价,只有氧化性,元素处于最低价,只有还原性,中间价态的元素既有氧化性又有还原性。
(4)优先律——一种氧化剂同时与多种还原剂相遇,还原性强的还原剂优先发生反应。同理,一种还原剂同时与多种氧化剂相遇,氧化性强的氧化剂优先反应。
考点一 氧化性、还原性判断规律
例1、下列各组物质中,每种物质都既能被氧化又能被还原的是( )
A.Fe2+ S Cu2+ B.H3PO4 HNO2 H2SO4
C.H2S HCl H2SO3 D.S2- HClO NH3
解析:
A选项中Fe元素和S元素都处于中间价态,它们既能被氧化又能被还原,但Cu2+一般只具有氧化性,所形成的微粒很难被氧化。B选项中H3PO4和H2SO4一般只能被还原。C选项中H2S和HCl既含有较高价态的氢元素,又含有较低价态的硫元素和氯元素,H2SO3中的S显+4价,属于硫元素的中间价态,故该组中每种物质都既能被氧化,又能被还原。D选项中,-2价硫-3价氮元素只有还原性,D错。C选项正确。
技巧点拨:当元素具有可变化合价时,若化合价处于最高价态时,该元素只具有氧化性,处于最低价态时只具有还原性,处于中间价态时既具有氧化性又具有还原性。利用此规律可判断物质氧化性及还原性的有无,而不能判断物质氧化性及还原性的强弱。
考点二 氧化能力、还原能力强弱的判定
例2、有A2、B2、C2三种单质及其离子可进行如下反应:
2A-+C2=2C-+A2 2C-+B2=2B-+C2
(1)三种单质的氧化性由强到弱的顺序是:__________。
(2)三种离子的还原性由强到弱的顺序是:__________。
(3)若X-能与C2发生反应2X-+C2=2C-+X2,那么X2与B-能否发生反应? 说明理由。
解析:
根据:强氧化剂+强还原剂=较弱氧化剂+较弱还原剂的规律,由前一反应方程式可判断氧化性C2>A2,还原性A->C-,后一化学方程式可判断出氧化性B2>C2,
还原性C->B-。
则这三种单质氧化性由强到弱的顺序是B2>C2>A2,这三种离子的还原性顺序是
A->C->B-。
由(3)若X-能与C2发生反应2X-+C2=2C-+X2,即可判断氧化性C2>X2,而前已判断氧化性B2>C2,则氧化性B2>X2,可见X2与B-不能发生反应,若反应,则不符合两强两弱规律。
技巧点拨:在氧化还原反应中:
强氧化性物质+强还原性物→弱氧化性物质+弱还原性物质
氧化剂 还原剂 氧化产物 还原产物
即氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,利用此规律可判断在相同条件下物质氧化性及还原性的强弱,以及在同一状态下能否发生氧化还原反应。
考点三 先强后弱规律在解题中的应用
例3、已知反应2FeBr2+Br2=2FeBr3,可知向含1 mol FeBr2溶质的溶液中通入1 mol Cl2,被氧化的Br-的物质的量为________,反应的离子方程式为____________________。
解析:
由反应方程式2FeBr2+Br2=2FeBr3可判断Fe2+的还原性大于Br-的还原性,在FeBr2溶液中通入Cl2,Cl2首先与Fe2+发生反应。
l mol FeBr2含1 mol Fe2+和2 mol Br-
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
2 1
1 mol 0.5 mol
则还剩余0.5 mol Cl2。
2Br- + Cl2 = 2Cl- + Br2
2 1
1 mol 0.5 mol
可见被氧化的Br-为l mol。
反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-。
发散类比:同一氧化性物质与含多种还原性物质的溶液反应时,首先被氧化的是还原性较强的物质;同一还原性物质与含有多种氧化性物质的溶液反应时,首先被还原的是氧化性较强的物质。利用此规律,可判断物质发生氧化还原反应的实质及进行有关氧化还原反应的定理分析与计算。
考点四 有关氧化还原反应的计算
例4、3.84 g Cu与适量的未知浓度的硝酸反应,当铜全部溶解完毕后,在标准状况下共收集到2.24 L气体,求反应中消耗HNO3物质的量。
解析:
因为n(反应中消耗HNO3)=n(参加氧化还原反应HNO3)+n(参加非氧化还原反应HNO3)
而n(参加非氧化还原反应HNO3)=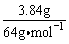 ×2=0.12mol
×2=0.12mol
又因为1 mol HNO3被还原生成1 mol NOx(x=1或x=2)
∴n(参加氧化还原HNO3)= 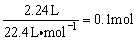
反应中共消耗HNO3物质的量为:0.1 mol+0.12 mol=0.22 mol。
技巧点拨:在金属和浓、稀硝酸以及浓H2SO4的反应中,浓、稀硝酸和浓H2SO4既作氧化剂又起酸的作用(生成盐和水)或者说浓、稀硝酸和浓硫酸既有一部分参加氧化还原反应又有一部分参加复分解反应。
例5、0.03 mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05 mol。该混合气体的平均相对分子质量可能是( )
A.30 B.46
C.50 D.66
解析:
用极端假设法解答。
(1)当产物中只有NO和NO2时平均相对分子质量有最小值。由氧化剂得电子和还原剂失电子守恒知:
n(NO)×3+n(NO2)×1=2×0.03
且n(NO)+n(NO2)=0.05
解之n(NO)=0.005 mol n(NO2)=0.045 mol
n(NO)︰n(NO2)=0.005︰0.045=1︰9
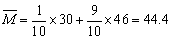
(2)当产物中只有NO2和N2O4时其平均相对分子质量有最大值。由得失电子守恒知:
n(NO2)×1+[0.05-n(NO2)]×2=0.03×2
n(NO2)=0.04 moln(N2O4)=0.01 mol
n(NO2)︰n(N2O4)=0.04︰0.01=4︰1
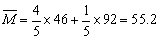
故选BC。
技巧点拨:氧化剂、还原剂在氧化还原反应中得失电子守恒这一规律不仅是有关氧化还原反应计算的根据,还是氧化还原反应方程式配平的理论根据。
要点2:热化学方程式及书写
(1)书写步骤:
①依据有关信息写出注明物质聚集状态的化学方程式,并配平。
②根据化学方程式中各物质的化学计量数计算相应的反应热的数值。
③如果为放热反应时则△H<0,如果为吸热反应时则△H>0,并写在第一步所得方程式的后面,中间用“;”隔开。
④如果题目另有要求,如有关燃烧热的热化学方程式和有关中和热的热化学方程式,可将热化学方程式的化学计量数变换成分数。
(2)注意事项:
①要注明反应时的温度和压强,若未注明温度和压强则表示常温常压;
②要注明各物质的状态和晶型(如白磷、红磷两种晶型),当物质的聚集状态不同时,反应热的数值也不同;
③热化学方程式中的化学计量数以“mol”为单位,它可以是整数,也可以是分数。当化学计量数不同时,△H也不同,但△H的单位始终是kJ·mol-1;kJ·mol-1中每摩不表示具体的某种物质表示每摩尔反应。
④△H>0时反应为吸热反应,△H<0时反应为放热反应,所以△H的值一定带有“+”、“-”号。
⑤热化学方程式之间可以叠加。
考点一 热化学方程式书写正误判断
例1、SO2和O2是在催化剂表面上接触时发生反应的,所以这种生产硫酸的方法叫接触法,接触法制硫酸的工艺中SO2的转化率为90%,已知在101 kPa 时每l mol SO2被氧化成l mol SO3放出热量98.3 kJ,则下列热化学方程式正确的是( )
A.SO2(g)+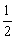 O2(g)
O2(g)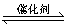 SO3(g);△H=-98.3 kJ·mol-1
SO3(g);△H=-98.3 kJ·mol-1
B.2SO2(g)+O2(g)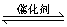 2SO3(g);△H=-176.94 kJ·mol-1
2SO3(g);△H=-176.94 kJ·mol-1
C.SO2(g)+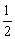 O2(g)
O2(g)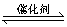 SO3(g);△H=-88.47 kJ·mol-1
SO3(g);△H=-88.47 kJ·mol-1
D.2SO2(g)+O2(g)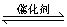 2SO3(g);△H=+196.6 kJ·mol-1
2SO3(g);△H=+196.6 kJ·mol-1
解析:
热化学反应方程式的△H只与反应物的总键能和生成物的总键能有关,与反应进行程度以及反应物的转化率无关。
答案:A
考纲解读:最新《考试大纲》将热化学方程式的含义由了解层次变为理解层次,标志着作为考点热化学方程式在高考中出现的考查方式可能向深层次方向递进,从近几年的全国理综化学试题和单科化学试题来看,命题的方式和考查的角度的确不同,秉承全国命题方向特设计本题。
考点二 对中和热概念的理解
例2、含有11.2 g KOH溶质的稀溶液与I L 0.1 mol·L-1的稀H2SO4溶液反应放出11.46 kJ的热量,表示该反应的中和热的热化学反应方程式是( )
A.KOH(aq)+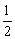 H2SO4(aq)=
H2SO4(aq)=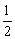 K2SO4(aq)+H2O(l);△H=-11.46 kJ·mol-1
K2SO4(aq)+H2O(l);△H=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);△H=-114.6 kJ·mol-1
C.2KOH(aq)+H2SO4(aq)K2SO4(aq)+2H2O(l);△H=+114.6 kJ·mol-1
D.KOH(aq)+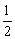 H2SO4(aq)=
H2SO4(aq)=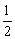 K2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1
解析:
根据中和热的概念:在稀溶液中,酸跟碱发生中和反应生成1 mol H2O所放出的热量叫中和热。应选择n(KOH)=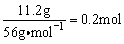 为计算标准。0.2 mol︰11.46 kJ=l mol︰△H,△H=-57.3 kJ·mol-1。
为计算标准。0.2 mol︰11.46 kJ=l mol︰△H,△H=-57.3 kJ·mol-1。
答案:D
大纲解读:《考试大纲》要求考生了解燃烧热、中和热的含义,掌握简单的反应热计算。中和热在课本中给出了明确的定义,为帮助考生进一步深化中和热的定义特设计本题。
考点三 化学键键能与△H的关系
例3、通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热△H为( )
Si(s)+4HCl(g),该反应的反应热△H为( )
A.+412 kJ·mol-1
B.-412 kJ·mol-1
C.+236 kJ·mol-1
D.-236 kJ·mol-1
解析:
在晶体硅中由于1个Si可形成4个Si—Si键,每个Si原子对一个Si—Si键的贡献为 ,故在硅晶体中n(Si)︰n(Si—Si)=l︰(4×
,故在硅晶体中n(Si)︰n(Si—Si)=l︰(4×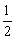 )=1︰2。所以每生成1 mol Si,则形成2 mol Si—Si键,故有:△H =4×360 kJ·mol-1+2×436 kJ·mol-1-(2×176 kJ·mol-1+4×431 kJ·mol-1)=+236 KJ·mol-1。
)=1︰2。所以每生成1 mol Si,则形成2 mol Si—Si键,故有:△H =4×360 kJ·mol-1+2×436 kJ·mol-1-(2×176 kJ·mol-1+4×431 kJ·mol-1)=+236 KJ·mol-1。
答案:C
大纲解读:将晶体中的有关考点同化学反应中的能量变化结合起来考核考生分析问题和解决问题的能力,即学科内小综合题型,是近年来高考开发出的一种新题型,这种题型是按照《考试大纲》能力要求而设计的。
例1、锰的氧化物MnO2、Mn2O3、Mn3O4,Mn2O7在加热时均能和浓盐酸反应生成MnCl2和Cl2。现有11.45 g锰的某种氧化物跟足量的盐酸反应,产生的氯气在标准状况下的体积为1.12 L,则参加反应的氧化物是( )
A.MnO2 B.Mn2O3
C.Mn3O4 D.Mn2O7
解析:
设符合题意的锰的氧化物分子式为MnOx,在反应中Mn2x得电子还原成Mn2x+,化合价降低至+2价,得电子总数为(2x-2);Cl-在反应中失电子,化合价升高到0价,失电子总数为1,由得失电子总数相等有关系式:
MnOx ~ (2x-2)Cl-
(55+16x)g (2x-2)mol
11.45 g 0.05×2 mol
(55+16x)︰11.45=(2x-2)︰0.1,解得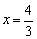
由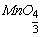 可推出该化合物为Mn3O4。
可推出该化合物为Mn3O4。
答案:C。
技巧点拨:氧化还原反应的内容是高考重点内容之一,它渗透于整个中学化学的始终,在解答有关氧化还原反应试题时一定要紧扣电子的转移守恒,解答本题紧扣得失电子守恒。
例2、已知反应:
①25℃、101 kPa时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是( )
A.N2H4的燃烧热大于534 kJ·mol-1
B.①的反应热为534 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量
解析:
1 mol N2H4在101 kPa 25℃时完全燃烧生成N2和液态水所放出的热量叫N2H4的燃烧热,现1 mol N2H4完全燃烧生成气态水放热534 kJ,易知N2H4的燃烧热大于534 kJ·mol-1,反应①的反应热△H =-534 kJ·mol-1,A对B错;稀H2SO4与稀NaOH溶液反应的中和热为57.3 kJ·mol-1不必加“-”,C错;CH3COOH是弱酸,其电离是吸热反应,故与NaOH溶液中和生成1 mol H2O时放出热量小于57.3 kJ。
答案:A
技巧点拨:反应热△H是表明该反应是吸热反应还是放热反应的物理量,因此谈到反应热一定要指明是放热还是吸热,标明吸热与放热的符号是“+”和“-”,而中和热、燃烧热用文字说明时,无需标明“+”与“-”。
例3、将8.4 g Fe溶于一定量稀HNO3中完全反应后,测得溶液中n(Fe2+)=n(Fe3+),则稀HNO3中含HNO3的物质的量为( )
A.0.4 mol B.0.8 mol
C.0.5 mol D.0.2 mol
解析:
I、经典方法即常规方法:利用电子守恒和原子守恒法解。因稀HNO3的还原产物是NO,8.4 g Fe即0.15 mol Fe被氧化成Fe2+、Fe3+且n[Fe(NO3)2]=n[Fe(NO3)3]=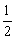 ×0.15 mol=0.075 mol,因稀HNO3中含n(HNO3)=n(被还原的HNO3)+n(起酸性作用的HNO3)=0.075 mol+0.075 mol×
×0.15 mol=0.075 mol,因稀HNO3中含n(HNO3)=n(被还原的HNO3)+n(起酸性作用的HNO3)=0.075 mol+0.075 mol×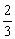 +3×0.075 mol+2×0.075 mol=0.5 mol。
+3×0.075 mol+2×0.075 mol=0.5 mol。
Ⅱ、简捷解法:写出并配平化学反应方程式
6Fe + 20HNO3 = 3Fe(NO3)3+3Fe(NO3)2+ 5NO↑+10H2O
6 mol 20 mol
0.15mol 0.5 mol
技巧点拨:将化学基本概念和元素及其化合物知识结合起来进行考查是近年来高考命题中常见方式和题型,这种题型体现了《考试大纲》对考生的能力要求——要求考生能综合应用。
例4、已知Na2SO4·10H2O溶于水,溶液温度降低。Na2SO4·10H2O受热分解的热化学方程式为:Na2SO4·10H2O(s)=Na2SO4(s)+10H2O(l);△H =+a kJ·mol-1,室温下,若将1 mol无水Na2SO4溶于水配成溶液时放热b kJ(a、b均为正值),则( )
A.a>b B.a=b
C.a<b D.无法确定
解析:
Na2SO4·10H2O(s)=Na2SO4(s)+10H2O(l);△H =+a kJ·mol-1 ①
Na2SO4(s)=2Na+(aq)+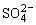 (aq);△H=-b kJ·mol-1 ②
(aq);△H=-b kJ·mol-1 ②
①+②得Na2SO4·10H2O(s)=2Na+(aq)+ (aq)+10H2O(l);△H =(a-b)kJ·mol-1。因Na2SO4·10H2O溶于水,溶液温度降低,故Na2SO4·10H2O溶于水的反应热△H>0,所以a-b>0,故a>b。
(aq)+10H2O(l);△H =(a-b)kJ·mol-1。因Na2SO4·10H2O溶于水,溶液温度降低,故Na2SO4·10H2O溶于水的反应热△H>0,所以a-b>0,故a>b。
答案:A
技巧点拨:盖斯定律是化学第三册以阅读教材形式出现在课本中的主要考点,《考试大纲》要求考生掌握“简单的热化学方程式的计算”,即要求考生能运用盖斯定律解题,通过对本题的解答可深刻领会盖斯定律的精髓。
例5、下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=KAc(aq)+H2O(l);△H=-Q2kJ·mol-1
②C(s)+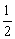 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+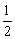 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+ O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
A.①② B.③④
C.②④ D.①③
解析:
①~④所列的8个热化学方程的△H均为负值,即都表示是放热反应,故只需比较Q值的大小即可。注意本题不是比较△H的大小而是比较Q值的大小。①中,强酸强碱的中和热大于弱酸强碱的中和热,所以①中Q1>Q2,②中C完全燃烧放出的热量Q2大于物质的量的C不完全燃烧放出的热量Q1,所以Q2>Q1,③中两热化学方程式相减得:4Al(s)+2Fe2O3(s)=4Fe(s)+2Al2O3(s);△H =-Q1-(-Q2)<0,所以Q1>Q2,④中等物质的量的H2燃烧生成液态水放出的热量多,故Q2>Q1。
答案:D
技巧点拨:比较反应热的大小即比较△H的大小,是2006年江苏卷首次出现的新题型,这题型是根据《考试大纲》要求考生理解热化学方程式的含义而设计的新题型,我们可从本题的解答中归纳这类题型的规律。
例6、CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下完全燃烧,转移的电子数之比是________。
(2)已知在10l kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧的热化学方程式是_______________。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为_________(保留2位小数)。
②若燃烧后气体体积缩小了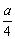 mL,则a与b关系的数学表示式是________________。
mL,则a与b关系的数学表示式是________________。
解析:
(1) ,相同条件下,气体的体积相同则物质的量也相同,而1 mol CO燃烧转移2 mol e-,l mol CH4燃烧转移8 mol e-,故转移电子数之比为1︰4。
,相同条件下,气体的体积相同则物质的量也相同,而1 mol CO燃烧转移2 mol e-,l mol CH4燃烧转移8 mol e-,故转移电子数之比为1︰4。
(2)2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=-283×6.30 kJ·mol-1
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-891.45 kJ·mol-1
(3)设a mol中CO的体积为x,CH4的体积为y,则

②因在120℃101 kPa下CH4完全燃烧气体体积不变,故气体减少为CO所致
2CO + O2 CO2 △V
CO2 △V
x 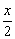

即CO有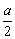 mL,CH4有
mL,CH4有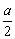 mL,要使二者完全燃烧,故
mL,要使二者完全燃烧,故 。
。
答案:
(1)1︰4
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-891.45 kJ·mol-1
(3)①0.33 ②
大纲解读:最新《考试大纲》要求考生能正确理解化学反应中物质变化和能量变化的关系。根据考纲的这一要求将化学反应中的物质变化和能量变化综合起来进行考核便成为理综化学试题中出现的一种新题型。本题便属于这种题型。