1、复习要点阐述
(1)化学计算是从“量”的角度来描述物质的化学变化,而从“量”的角度来描述物质的化学变化离不开“物质的量”,因此有关物质的量的计算一直贯穿中学化学的始终而成为高三复习备考的重点和难点。而准确地掌握概念是化学计算的重点,很多基本计算题就是概念题,很多综合计算题,也是结合多项概念找出相关关系才进行计算的。通过对概念的深入理解,可以灵活、正确地进行计算,通过计算又可以巩固和深化概念;如果概念不清、化学意义不明,就无法正确地运算。必须克服重视数学运算而轻视化学概念的错误认识,克服重视计算的技能、技巧而轻视解题思想的错误倾向。
(2)最新《考试大纲》要求考生掌握8类化学计算的综合应用。在《考试大纲》规定的8种类型的计算中最基础的计算是:①物质的量在化学方程式中计算的应用;②涉及化学方程式的计算。这是因为化学计算是从量的角度来描述化学变化,而化学反应方程式又是描述化学变化最简洁的语言,因此在第一轮高三备考复习过程中,我们必须以上述两类计算为基础:首先搞清楚化学方程式所表示的意义以及反应物和生成物化学计量数之间的关系:然后才会有解题技巧可言。
2、要点复习的策略及技巧
考点一:以选择题的形式考查计算技巧
例1、2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A.2.1g B.3.6g
C.7.2g D.无法确定
解析:
2CO+O2=2CO2 ①
2Na2O2+2CO2=2Na2CO3+O2 ②
由①式+②式得:Na2O2+CO=Na2CO3
由关系式Na2O2+CO=Na2CO3知CO燃烧后的产物通过足量Na2O2固体后,固体增加的质量即等于CO的质量。同理可得H2燃烧后的产物通过Na2O2后质量增重的关系式:Na2O2+H2=2NaOH,亦可得出H2燃烧后的产物通过Na2O2固体,固体增重的质量即为H2的质量,易知A正确。
技巧归纳:凡是分子式能写成n CO·m H2的化合物完全燃烧后的产物通过足量Na2O2固体后,固体增重的质量即为该化合物的质量。例如葡萄糖C6H12O6可改写成6CO·6H2,故C6H12O6完全燃烧后的产物通过足量Na2O2固体后,固体增重的质量等于葡萄糖的质量。
考点二:NOx和O2溶于水的计算常考常新
例2、将30mL NO2和O2的混合气体通入倒置于水槽且装满水的量筒中,充分反应后,量筒内剩余5mL气体,则原混合气体的体积组成是( )
A.NO2:20mL;O2:10mL B.NO2:27mL;O2:3mL
C.NO2:15mL;O2:15mL D.NO2:25mL;O2:5mL
解析:
(1)若5mL是O2,则设参与反应的O2的体积为x:
4NO2+2H2O+O2=4HNO3
4x x
4x+x=(30-5)mL
x=5mL
体积组成为:
V(NO2)=20mL
V(O2)=5mL+5mL=10mL
(2)若5mL是NO,则生成5mL NO需耗15mL NO2,即有15mL NO2没有转化为HNO3,设O2的体积为y:
4NO2+O2+2H2O=4HNO3
4y y
4y+y=30mL-15mL
y=3mL
混合气体体积组成为
V(NO2)=27mL
V(O2)=3mL
故AB正确。
技巧归纳:有关NOx和O2溶于水的计算常用的两个关系式的推导过程如下:
(1)当NO2中的氮全部转化为硝酸中的氮时,NO2与O2关系式推导
2NO+O2=2NO2 ①
3NO2+H2O=2HNO3+NO ②
为消去NO将②×2+①得
4NO2+O2+2H2O=4HNO3
(2)当NO中氮全部转化为HNO3中的氮时,NO与O2关系式推导
2NO+O2=2NO2 ①
3NO2+H2O=2HNO3+NO ②
为消去NO2将①×3+②×2得
4NO+3O2+2H2O=4HNO3
考点三:寓计算于推理之中实验计算新题型
例3、常温下混和气体可能由Cl2、HCl、NO、H2、O2、CO2、N2、NH3和Ne等气体中的一种或几种组成。取200mL该混和气体进行如下实验:
(1)将混和气体通过浓H2SO4体积减少40mL;
(2)剩余气体通过足量过氧化钠固体反应完全后体积又减少40mL;
(3)剩余气体引燃后,冷却至室温,体积减少105mL;
(4)剩余15mL气体,其中氧气为5mL。
回答:
①混和气体中一定有哪些气体,各多少毫升?________________
②混和气体中一定没有哪些气体________________
③混和气体中可能有哪些气体________________
解析:
由(1)知V(NH3)=40mL,有NH3则无Cl2,HCl。由(3)知反应必为
2H2 + O2=2H2O(l) △V
2 1 0 3
70mL 35mL 105mL
则可知V(H2)=70mL
35mL O2来源未定(可能是原混和气体中有O2,也可能是通过Na2O2后生成)。
由(4)知残余V (N2+Ne)=15mL-5mL=10mL
余下气体V(余)=200mL-70mL-40mL-10mL=80mL,其可能组成为:①CO2、 NO ②CO2、O2 ③CO2。现分别予以讨论:
①若80mL气体是CO2和NO组成则通过Na2O2反应为:
2Na2O2+2CO2=2Na2CO3+O2 ①式
2NO+O2=2NO2 ②式

由NO→NO2为体积不变之反应,故V(CO2)︰V(NO)≥1符合题意,但若有NO则不可能生成40mL O2,而(3)中反应说明V(O2)=40mL(耗掉35mL O2;残余5mL O2)故80mL O2不可能是CO2和NO。
②若80mL全部是CO2,则由2Na2O2+2CO2=2Na2CO3+O2知80mLCO2符合题意,因通过Na2O2后生成40mLO2,故80mL气体中不可能有O2。
经上述讨论知80mL气体只可能是CO2。
答案:
(1)V(NH3)=40mL, V(CO2)=80mL, N2和Ne或两种中之一10mL, V(H2)=70mL
(2)HCl、Cl2、NO、O2
(3)N2和Ne至少有1种
技巧归纳:通过严密计算讨论实验现象,进而由实验现象得出实验结论是解答这类新题型的关键。
考点四:计算数据选择型推理计算
例4、1.01×105Pa 120℃时,4mL O2和3mL分子组成可表示为NxHy(y>x)的混合气体经电火花引燃,完全反应后恢复至原温度和原压强时,测得反应后由N2、O2和水蒸气组成的混合气体的密度比原混合气体的密度减小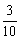 ,试解答下列问题:
,试解答下列问题:
(1)写出气体NxHy燃烧的化学方程式。
(2)求x和y的值。
(3)写出NxHy的结构式。
解析:
解答本题的思路是:密度减少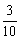 ,则密度为原来的
,则密度为原来的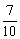 ,由题意知反应前后质量不变,又由
,由题意知反应前后质量不变,又由 ,因V(前)=4mL+3mL=7mL,可求出V(后)=10mL,由反应后混合气体中有O2知4mL O2过量,3mL NxHy完全反应,故应选择3mL NxHy为计算标准:
,因V(前)=4mL+3mL=7mL,可求出V(后)=10mL,由反应后混合气体中有O2知4mL O2过量,3mL NxHy完全反应,故应选择3mL NxHy为计算标准:
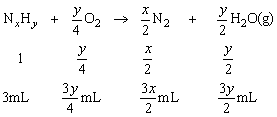
由题意知: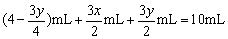 ,化简得:2x+y=8,因y>x,经讨论x=2,y=4符合题意。
,化简得:2x+y=8,因y>x,经讨论x=2,y=4符合题意。
答案:

(2)x=2,y=4
(3)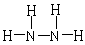
技巧归纳:解答本题的关键有如下两点:
(1)利用反应前后气体的密度变化求出V(后)=10mL。
(2)选择3mL NxHy作为计算标准求出反应后:V(剩余O2)+V(N2)+V(水蒸气)=10mL,建立不定方程讨论求解。
考点五:寓计算于实验之中的新题型
例5、蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。
由蛇纹石制取碱式碳酸镁的实验步骤如下:
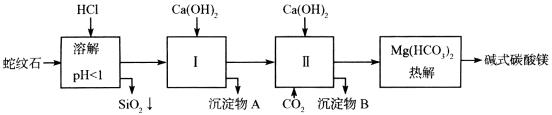
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是___________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
开始沉淀pH |
1.5 |
3.3 |
9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后___________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_________ (填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完成下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量②高温分解③_________ ④_________ ⑤MgO称量
(6)18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:a=_________b=_________c=_________。
解析:
整个实验步骤可解析如下:
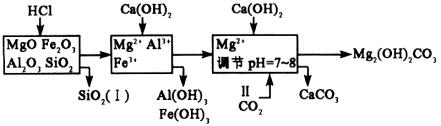
由上述图示知:(1)(2)(3)(4)答题则不解自明。
(5)a MgCO3·b Mg(OH)2·c H2O高温分解后生成H2O(g),需用浓H2SO4吸收以测定水的质量,生成的CO2需用碱石灰吸收称重以测定CO2质量。
(6)18.2g产品完全分解后, 而
而 ,由两部分组成①Mg(OH)2
,由两部分组成①Mg(OH)2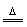 MgO+H2O,②产品中结晶水;而
MgO+H2O,②产品中结晶水;而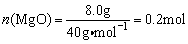 ,由两部分组成①MgCO3
,由两部分组成①MgCO3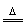 MgO+CO2↑,Mg(OH)2
MgO+CO2↑,Mg(OH)2 MgO+H2O。
MgO+H2O。
所以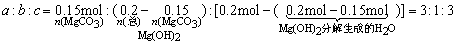
答案:
(1)Fe3+、Al3+
(2)Al(OH)3、Mg(OH)2
(3)NaOH或Ca(OH)2;过滤、洗涤、灼烧
(4)CaCO3(CO2)
(5)用浓H2SO4吸收H2O(g),称量碱石灰吸收CO2前后质量;测出水蒸汽的质量
(6)3、1、3
例1、在浓度均为3mol·L-1的盐酸和硫酸各100mL中,分别加入等质量的铁粉,反应完毕后生成气体的质量比为3︰4,则加入铁粉的质量为( )
A.5.6g B.8.4g
C.11.2g D.1.8g
解析:
已知n(HCl)=0.1L×3mol·L-1=0.3mol
n(H2SO4)=0.1L×3mol·L-1=0.3mol
又Fe + 2HCl = FeCl2+H2↑
0.15mol 0.3mol
Fe + H2SO4 = FeSO4 + H2↑
0.3mol 0.3mol
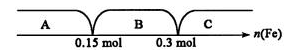
A区:n(Fe)对二者均不足,故按Fe计算生成H2的量,而铁的量相同,故
C区:n(Fe)对二者均过量,故按酸计算,
B区:n(Fe)对盐酸过量,对H2SO4不足,故
计算得n(Fe)=0.2mol,即m(Fe)=0.2mol×56g·mol-1=11.2g
答案:C
技巧归纳:利用数轴可将某些讨论型计算题的已知条件清楚直观地展现出来,利用数轴解题的关键在于选定数轴上某些具有化学意义的点。例如本题数轴上所表示的两个特殊点即是Fe的物质的量:0.15mol和0.3mol。
例2、将2mol NaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量n的取值范围是( )
A.n=l B.l<n<2
C.2≤n<4 D.n≥4
解析:
①由2mol NaHCO3和足量Na2O2反应可求出n(固体)的最小值:
2NaHCO3=Na2CO3+CO2↑+H2O
2mol 1mol 1mol 1mol
2Na2O2+2H2O = 4NaOH +O2
1mol 2mol 1mol
2NaOH + CO2 = Na2CO3 + H2O
2mol 1mol 1mol 1mol
生成2种气体O2和H2O(g),n(固)=1mol+1mol=2mol;
②由2mol NaHCO3中C、H元素守恒可求出n的最大值:若2mol NaHCO3中C元素全部转化为Na2CO3中C元素,则n(Na2CO3)=2mol,若2mol NaHCO3中H元素全部转化为NaOH中H元素,所以生成n(固)=n(NaOH)+nNa2CO3=4mol,2mol NaHCO3中O元素转化为O2中O元素,故气体仅1种O2,若要满足题目要求的2种气体,则必须使NaOH中H、O两元素转化为H2O(g),故n(固)<4mol,综上所述2≤n<4为所求。
答案:C
技巧归纳:极端假设法通常适用于解决下列问题:(1)判断混合物的组成:当混合物(反应物或生成物)组成不能直接确定时,可采用极端假设法,分析出两个端点(极限点),可得问题的结论必介于两端点之间。(2)判断物质所含杂质的成分:当某一物质混有未确定的杂质时,可将混合物假设成单一的物质来求解,然后与题给杂质相比较,便可求解出结果。在解题时,常将题给的可能杂质的化学式进行变形,以使计算简化、快捷。(3)判断化学平衡中的有关量:根据可逆反应的概念可知,任何一种反应物不可能全部转化成生成物。在求解某问题时,先假设反应是定向反应,按反应物中不足量的物质,求出某产物的最大值名因反应实际是可逆反应,不可能进行彻底,其实际值将介于最大值和最小值(题设条件)之间,即可得出结果。
例3、在标准状况下,若向100.0mL溴化亚铁溶液中通入268.8mL的Cl2时有70%的溴被氧化,求原溴化亚铁溶液的物质的量浓度为多少?并写出发生反应的离子方程式。
解析:
设FeBr2为x mol,利用电子守恒可写出: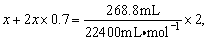
解得:x=0.01mol,
答案:
0.1mol·L-1; 10Fe2++14Br-+12Cl2=10Fe3++24Cl-+7Br2
规律总结:量化离子反应方程武的书写规律:参加反应的各物质化学计量数之比等于参加反应的各反应物物质的量之比,然后再利用质量守恒确定生成物种类及化学计量数,例如本题:n(Fe2+)︰n(Br-)︰n(Cl2)=0.01︰0.02×0.7︰0.012=10︰14︰12可写出:10Fe2++14Br-+12Cl2=10Fe3++24Cl-+7Br2。
例4、在标准状况下,将100mL H2S和O2的混合气体点燃,反应后恢复到原状况,发现反应后所得气体总体积V(总)随混合气体中O2所占的体积V(O2)的变化而不同。若气体的体积均在同温同压下测定,试回答下列问题:
(1)以反应后气体总体积V(总)为纵坐标,以氧气在100mL混合气体中所占体积V(O2)为横坐标,画出有关变化图象。

(2)当V(总)=80mL时,反应后气体成分可能是__________。(只填化学式,下同)
(3)当V(总)=20mL时,反应后气体成分可能是__________。
(4)试写出V(总)与V(O2)的函数关系式。
解析:
(1)当V(O2)=0时,V(总)=V(H2S)=100mL,确定坐标点(0,100),当V(H2S)=0时,V(总)=V(O2)=100mL,确定坐标点(100,100)。
当V(总)=0时,标志着H2S和O2发生如下反应:
2H2S + O2 = 2S + 2H2O
2 1
[100-V(O2)] V(O2)

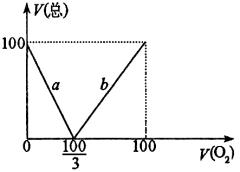
(2)由图象知当V(总)=80mL时,反应后气体可能是H2S或SO2和O2。
(3)当V(总)=20mL时,反应后气体可能是H2S或SO2。
(4)当0<V(O2)≤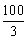 时,H2S过量,O2少量。则:
时,H2S过量,O2少量。则:
2H2S+ O2=2S+2H2O
2V(O2)V(O2) V(总)=[100-3V(O2)]mL
当 <V(O2)<100时,可能发生如下反应:
<V(O2)<100时,可能发生如下反应:
2H2S + O2 = 2S + 2H2O △V
2 1 0 0 3
2H2S + 3O2= 2SO2 + 2H2O △V
2 3 2 3
100-V(O2) 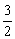 [100-V(O2)]
[100-V(O2)]

技巧点拨:解答本题时,要运用动态变化的观点去分析和处理H2S和O2相互反应中定量与变量之间的相互关系,并建立数学模型来解决化学问题。
例5、常温常压下,有CO和H2的混合气体12L,将它再和12L O2混合后,使其完全燃烧,恢复到起始温度和压强。请根据下列数据,求混合气体中V(CO)︰V(H2)的值。
(1)若燃烧后气体体积为12L,则原V(CO)︰V(H2)是多少?
(2)若燃烧后气体体积为a L,则原V(CO)︰V(H2)是多少?
(3)若燃烧后气体体积为a L,则a的取值范围上下限各是多少?
解析:
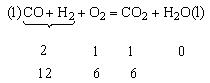
残余V(O2)=12L-6L=6L,因生成6L CO2故知混合气体中有V(CO)=6L,所以原混合气体中:V(CO)︰V(H2)=6︰6=1︰1。
(2)由:CO+H2+O2=CO2+H2O(l),知a=V(CO2)+6;因V(CO)=V(CO2)=a-6,所以V(H2) =12-V(CO)=12-(a-6)=18-a,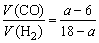 。
。
(3)12L H2和CO完全燃烧消耗6L O2残余6L O2。
若12L气体全部是CO,则生成CO2为12L体积不变,因此a的最大值为12+6=18,但实际上有H2燃烧生成液态水,故a的最大值应小于18,而不等于18,同理其最小值应大于6而不可能等于6。故6<a<18。
技巧归纳:H2、CO和O2混合燃烧的有关计算一直是高考的热点计算题,在解答这一类计算题时应从化学反应方程式: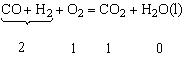
悟出两点信息:①CO和H2组成的混合气体不论其比例组成如何总是完全燃烧2体积混合气体,必消耗1体积O2;②由生成CO2的体积可确定混合气体中CO的体积。由生成物H2O的物质的量可确定H2的物质的量。以上两点隐藏信息的挖掘往往是解题的基础,因此我们在解题时要注重从有关化学反应方程式中挖掘解题信息。
例6、实验室中有甲、乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲、乙两瓶溶液的成分及其物质的量浓度,现操作如下:①量取25.00mL甲溶液,向其中缓缓滴加乙溶液15.00mL,共收集到CO2气体224mL(标准状况)。②量取15.00mL乙溶液,向其中缓缓滴加甲溶液25.00ml,共收集到CO2气体112mL。(标准状况)
请回答:(1)根据上述两种不同操作过程及实验数据可判断甲溶液是__________,乙溶液是__________。
(2)用离子方程式表示两次操作得到不同气体体积的原因:
①__________________________________________________;
②__________________________________________________。
(3)甲溶液的物质的量浓度为__________mol·L-1,(CO2在水溶液中的少量溶解忽略不计)。
(4)将n mL的甲溶液与等体积的乙溶液按各种可能的方式混合,产生的气体体积为V mL(标准状况),则V的取值范围为__________。
解析:
(1)当向盐酸中滴加Na2CO3溶液时因HCl过量Na2CO3少量,故开始滴入时即有CO2放出,若酸过量此时放出CO2最多,反之若向Na2CO3溶液中滴入盐酸因酸少量,则放出CO2最少。据此可知甲为盐酸,乙为Na2CO3溶液。
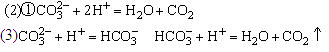
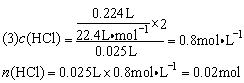
设Na2CO3物质的量为x mol,则有:
Na2CO3+HCl=NaHCO3+NaCl
x x
NaHCO3+HCl=NaCl + CO2↑ + H2O
0.005mol 
由共耗n(HCl)有:x+0.005mol=0.02mol
x=0.015mol
(4)向Na2CO3溶液中滴入盐酸以HCl物质的量为计算标准,CO2有极大值:
V(CO2)=0.8n×22400=8.96n mL
向HCl溶液中滴入Na2CO3溶液生成CO2有极小值
Na2CO3 + HCl= NaHCO3 + NaCl
1.0n 0.8n
V(CO2)=0综上所述:0≤V≤8.96n
答案:
(1)甲:HCl、乙:Na2CO3
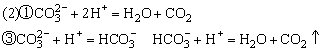
(3)0.8
(4)0≤V≤8.96n
技巧归纳:过量问题计算亦称讨论型计算题,这类题型通常有如下3个特点:(1)同时给出两种反应物的量。(2)给出一种反应物和一种生成物的量。(3)给出两种反应物组成的混和物的总质量。解答过量问题的一般方法是分类讨论,特别需要注意的是当某种物质过量时,可能又发生新的反应。如本题中Na2CO3和HCl的反应即属此类,这往往是过量问题中一类较难又易忽视的问题。