1、复习要点阐述
最新《考试大纲》将五种基本实验技能列为综合运用层次,这是因为化学是一门以实验为基础的科学,虽然笔试不易考查考生的操作技能,但是近几年高考命题还是充分关注了对真正做过实验的考生的选拔。因此,对高三最后冲刺复习备考特建议如下:
(1)每一个实验重温一遍,加深印象。在复习实验时,不仅要知道怎么做,还要知道为什么这样做,以及不这样做会导致怎样的后果。
(2)进一步明确化学实验仪器的作用及实验操作的规范要求。
(3)通过实验原理和方法的多向思维训练,提高创新意识。学生要认真掌握实验原理、实验装置、实验过程中产生的现象、产生该现象的原因,与此同时还要思考一些相关问题,如能否用其他方法或装置,完成同一实验或类似的实验,培养多角度思考问题的习惯,进行“发散”和“求异”思维的训练,以提高创新意识。
2、要点复习的策略及技巧
考点1:选择题给仪器考查实验设计的能力
例1、水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2。(加热装置和导管等在图中略去)
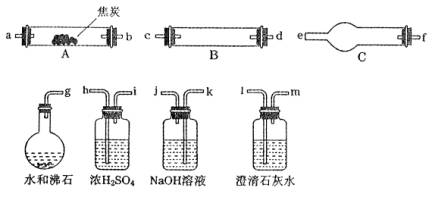
回答下列问题:
(1)盛浓H2SO4的装置的用途是________________________________________,盛NaOH溶液的装置的用途是________________________________________。
(2)仪器B中需加入试剂的名称(或化学式)是:___________________________,所发生反应的化学方程式是:__________________________。
(3)仪器C中需加入试剂的名称(或化学式)是:____________________________,其目的是________________________________________。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:
g—ab—________________________________________。
(5)能证明混合气中含有CO的实验依据是____________________________。
(6)能证明混合气中含有H2的实验依据是____________________________。
答案:
(1)除去水蒸气 除去CO2
(2)氧化铜 (CuO)CuO+H2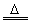 Cu+H2O CuO+CO
Cu+H2O CuO+CO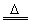 Cu+CO2
Cu+CO2
(3)无水硫酸铜(CuSO4) 检验H2O
(4)(g—ab)—kj—hi—cd(dc)—fe—lm
(5)原混合气中的CO2已被除去,其中CO与CuO反应生成的CO2使澄清石灰水变浑浊
(6)原混合气中的H2O已被除去,其中H2与CuO反应生成的H2O使无水硫酸铜由白色变为蓝色
技巧归纳:本题为一道综合考查物质的制备、除杂、检验及仪器组装的综合性实验方案设计题。解答本题的切入点是正确组装实验仪器,欲正确组装仪器必须先制备水煤气即加热水产生水蒸气进入装置A与焦炭反应产生CO、H2、CO2和H2O(g)等混合气体,为排除对CO检验的干扰,首先应用NaOH溶液洗气除去混合气体中的CO2,再用浓H2SO4洗气除去H2O(g) ,以排除对H2检验的干扰,将剩余H2和CO再通过足量CuO发生如下反应:CuO+H2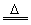 Cu+H2O,CuO+CO
Cu+H2O,CuO+CO Cu+CO2,再用CuSO4、澄清石灰水分别验证生成的H2O和CO2,进而确证水煤气中含H2和CO。
Cu+CO2,再用CuSO4、澄清石灰水分别验证生成的H2O和CO2,进而确证水煤气中含H2和CO。
考点2:模拟工业生产情景设计实验
例2、二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
S |
112.8 |
444.6 |
略 |
S2Cl2 |
-77 |
137 |
遇水生成HCl、SO2、S;300℃以上完全分解;S2Cl2+Cl2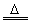 2SCl2 2SCl2 |
设计实验装置图如下:
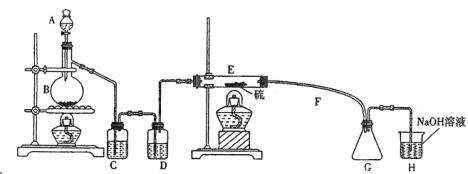
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见__________
______________________________________________________________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:______________________________________;
E中反应的化学方程式:_________________________________________。
(3)C、D中的试剂分别是__________、__________。
(4)仪器A、B的名称分别是__________、__________,F的作用是________________。
(5)如果在加热E时温度过高,对实验结果的影响是______________________,在F中可能出现的现象是_______________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) __________、__________,为了提高S2Cl2的纯度,关键的操作是控制好温度和______________________________。
答案:
(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗)在G和H之间增加干燥装置
(2)MnO2+4H++2Cl-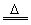 Mn2++Cl2↑+2H2O 2S+Cl2
Mn2++Cl2↑+2H2O 2S+Cl2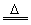 S2Cl2
S2Cl2
(3)饱和食盐水(或水) 浓硫酸
(4)分液漏斗 蒸馏烧瓶 导气、冷凝。
(5)产率降低 有固体产生(或其他正确描述)
(6)SCl2、Cl2、S(任写其中两种即可)控制浓盐酸的滴速不要过快
技巧归纳:本题以探究一个简单的工业生产过程为背景,综合考查物质的制备、性质、检验等内容以检验学生的动手能力。在制备Cl2时,若分液漏斗内空气不与烧瓶内空气相通,则因产生气体过快而导致压强增大而使液体不易下滴,故在分液漏斗与烧瓶之间加一连通管;由题给信息可知S2Cl2易与H2O反应,故应在G与H之间加一个干燥装置,以防产品吸收碱液中水蒸汔而水解。B中发生反应MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。产生的Cl2中混有HCl及水蒸气,故需先通过饱和食盐水,再通过浓H2SO4而除去;由题意知E中发生的化学反应为
Mn2++Cl2↑+2H2O。产生的Cl2中混有HCl及水蒸气,故需先通过饱和食盐水,再通过浓H2SO4而除去;由题意知E中发生的化学反应为 ,产生的S2Cl2经导气管F冷凝在G中得到产品。若加热温度过高,则S2Cl2会分解,硫也会变为蒸气使产率降低,在F中可能出现硫的固体;另由题给信息知产品中可能含有SCl2、Cl2、S等杂质,为避免S2Cl2与过量Cl2反应,应控制HCl的滴速不要太快。
,产生的S2Cl2经导气管F冷凝在G中得到产品。若加热温度过高,则S2Cl2会分解,硫也会变为蒸气使产率降低,在F中可能出现硫的固体;另由题给信息知产品中可能含有SCl2、Cl2、S等杂质,为避免S2Cl2与过量Cl2反应,应控制HCl的滴速不要太快。
考点3:实验和化学主干知识相结合的新题型
例3、短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
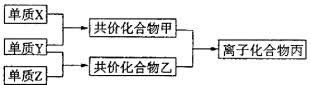
已知:a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子含10个电子,乙分子含18个电子。
(1)X的电子式是__________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
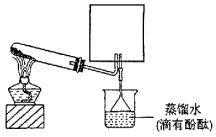
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)________________________________________。
③烧杯中溶液由无色变成红色,其原因是(用电离方程式表示)____________________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是____________________。
答案:
(1) 
(2)① ②NH4Cl、Ca(OH)2 ③
②NH4Cl、Ca(OH)2 ③
(3)PCl5 (4)P3N3Cl6
技巧归纳:本题是一道无机化学推断题。由题意知甲为NH3,乙为HCl,X为N2,Y为H2,Z为Cl2。因为NH3极易溶于水,密度比空气小,用向下排气法收集。2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,氨水呈碱性,滴入酚酞溶液变红,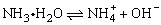 。磷在Cl2中燃烧生成PCl3和PCl5,由丁分子最外层不全是8电子结构知丁为PCl5。该化合物蒸气的密度是相同状况下氢气的174倍,故相对分子质量为174×2=348,由题意该化合物中N、P个数相同,设为(NP)xCly
。磷在Cl2中燃烧生成PCl3和PCl5,由丁分子最外层不全是8电子结构知丁为PCl5。该化合物蒸气的密度是相同状况下氢气的174倍,故相对分子质量为174×2=348,由题意该化合物中N、P个数相同,设为(NP)xCly
45·x+35.5·y=348
x=3,y=6
化学式为P3N3Cl6
反应式为3PCl5+3NH4Cl P3N3Cl6+12HCl
P3N3Cl6+12HCl
例1、在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L。现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
(1)CaC2和水反应的化学方程式是____________________。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是______________________________。
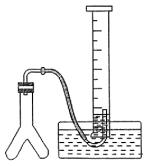
(3)本实验中测量气体体积时应注意的事项有____________________。
(4)如果电石试样质量为c g,测得气体体积为d L,则电石试样中CaC2的质量分数计算式w(CaC2)= __________。(杂质所生成的气体体积忽略不计)
解析:
本题主要考查简单的实验操作与简单的计算,属于基础题。由于CaC2与H2O的反应CaC2+2H2O→Ca(OH)2+C2H2↑,为剧烈的放热反应,故在没有恢复到室温时,内部气体压强不等于大气压,故不能取出导气管,即使在恢复到室温后,也应调节量筒使其内外液面持平时才能读数。由于产生C2H2的体积在相同条件下,与纯CaC2的质量成正比,所以有:a g·90%︰c g·w(CaC2)=b L︰d L,即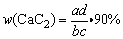 。
。
答案:
(1)CaC2+2H2O=Ca(OH)2+C2H2↑
(2)因为装置内气体的温度没有恢复到室温,气体压强还不等于大气压强
(3)待装置内气体的温度恢复至室温后,调节量筒使其内外液面持平
(4)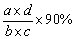
解题技巧:用排水法测量气体体积时一定要注意等温等压两个条件,所谓等温是指气体发生器和气体收集装置温度相同等压是指气体发生装置内压强和大气压强相等。
例2、实验室模拟合成氨和氨催化氧化的流程如下:
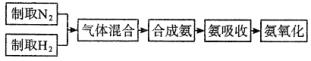
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。

(1)从上图中选择制取气体的合适装置:氮气__________、氢气__________.
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有__________、__________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,__________ (“会”或“不会”)发生倒吸,原因是________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:____________________,锥形瓶中还可观察到的现象是:______________________________。
(5)写出乙装置中氨氧化的化学方程式:____________________。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、__________、__________离子。
解析:
本题考查氨的合成和氨催化氧化的实验题。
合成NH3所用氮气用氯化铵溶液与亚硝酸钠(NaNO2)溶液加热反应生成,故选a装置,合成NH3所用氢气用锌与稀H2SO4反应不用加热,选b装置。甲装置的作用混合氮气、氢气,干燥气体,控制氮气和氢气的流速。从氨合成器中出来的气体主要是N2、H2,通入水中吸收氨气,因为N2、H2难溶于水,不会倒吸。氨的催化氧化是一个放热反应,铂丝保持红热,锥形瓶中发生下列反应:4NH3+5O2 4NO+6H2O,2NO+O2=2NO2有红棕色气体产生,3NO2+H2O=2HNO3+NO,HNO3+NH3=NH4NO3。
4NO+6H2O,2NO+O2=2NO2有红棕色气体产生,3NO2+H2O=2HNO3+NO,HNO3+NH3=NH4NO3。
答案:
(1)a b
(2)干燥气体 控制氢气和氯气的流速(合理即给分)
(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应有红棕色气体产生(合理即给分)
(5)4NH3+5O2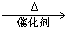 4NO+6H2O
4NO+6H2O
(6)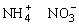
解题技巧:实验室制N2的装置为液—液反应要加热装置。反应方程式为:NH4Cl+NaNO2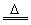 NaCl+N2↑+H2O
NaCl+N2↑+H2O
例3、以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是__________;
(2)指出实验步骤中存在的错误并改正:__________;
(3)硫酸钠不能放置在空气中冷却的原因是__________;
(4)步骤⑤的目的是__________;
(5)下面的情况有可能造成测试结果偏高的是__________(填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时晶体溅出
解析:
本题考查晶体中结晶水含量测定实验。
(1)称量坩埚及晶体需用托盘天平,加热坩埚晶体失水需用酒精灯、三脚架、泥三角、玻璃棒,冷却必须在干燥器中冷却,用坩埚钳转移坩埚,故缺少坩埚钳、酒精灯。
(2)第②步有错误,应先在研钵中研细再放入坩埚中称量。
(3)冷却热的Na2SO4必须放在干燥器中,否则热的Na2SO4又吸收空气中的水。
(4)步骤⑤重复操作减少误差使晶体全部失水。
(5)A.试样中有加热不挥发的杂质,相当于晶体中H2O含量降低,结果偏低。B.试样中有加热挥发的杂质,加热后减少的质量增加,结果偏高。C.部分脱水,水没有完全失去,加热后减少的质量少,结果偏低。D.坩埚未干燥,有水,加热后水的质量增大,结果偏高。E.晶体加热脱水不完全,加热后晶体没有完全失水,结果偏低。F.加热时晶体溅出,加热后晶体质量减少大,结果偏高。
答案:
(1)坩埚钳、酒精灯
(2)步骤②有错误应先将试样研细,后放入坩埚称重
(3)因硫酸钠放置在空气中冷却时,会吸收空气中的水分
(4)保证试样脱水完全
(5)B、D、F
解题技巧:在测定硫酸钠晶体结晶水含量实验中称量至少要进行4次:称量坩埚1次;称量坩埚和晶体计1次;加热冷却后称量坩埚和无水Na2SO4计1次;再加热再称量至2次称量的质量不超过0.1g为止共计称量4次。
例4、下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
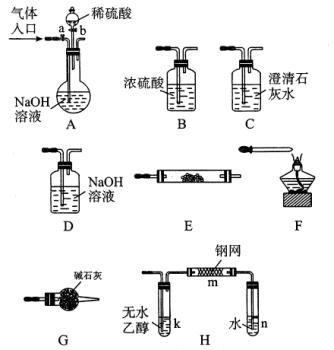
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为__________(填代号)。能验证CO氧化产物的现象是__________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应__________,活塞b应__________,需要加热的仪器装置有__________(填代号),m中反应的化学方程式为__________________。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:____________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有__________性。
解析:
本题为综合实验题,主要考查物质除杂、性质及实验步骤。
(1)分离提纯CO、CO2混合气体,先除去CO2,再检验CO2是否除净,干燥CO,CO与CuO反应氧化为CO2,最后检验生成的CO2,未反应的CO一定要处理,一般是点燃或收集。
答案:
(1)ACBECF
AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊
(2)关闭 打开 k、m
2CH3CH2OH+O2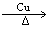 2CH3CHO+2H2O
2CH3CHO+2H2O
(3)①氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出 ②还原
解题技巧:某些气体是否一次被吸收完全,是否需要验证,其是否除尽应视题目的要求而定。例如SO2的吸收因SO2与品红溶液的反应为可逆反应,故吸收后需验证是否被完全吸收,而用NaOH溶液吸收CO2,若题目没有作特别要求则可视为一次吸收完全;若题目有特别要求,例如本题明确指出必要时可重复选择使用仪器,则应考虑验证其是否吸收完全。