1、复习要点阐述
从近年来高考化学单科和理综化学试题题型来分析,归纳解题技巧必须从化学学科知识板块的高度来分析这些题型所考核的知识结构。本专题拟从知识结构来分析高考命题题型走向,以帮助考生在最后冲刺阶段获得较灵活的复习方法和熟练的解题技巧。
(1)选择题一一化学三大理论考查的主题曲
选择题以其多变的形式、星罗密布的陷阱、声东击西的命题策略常用来考查考生对化学基本理论的掌握情况。近年来高考理综卷化学试题和化学单科试卷中对化学基本理论考查的题型以选择题居多。现举例予以说明。
考点1:元素周期律
例1、短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是( )
A.WZ2分子中所有原子最外层都为8电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X<W<Y<Z
解题思路:
因Y原子的内层电子总数是其最外层电子数的2.5倍,所以Y为非金属硅,故W为碳;由W与X可形成共价化合物WX2,结合题意可知X为氧,Z为硫。WX2为CO2,ZX2为SO2。X、Y、Z、W原子半径的大小顺序应为X<W<Z<Y,D错。答案:D。
点评:涉及8电子结构问题时,含氢元素的物质及常见的PCl5、BF3、SO3、SO2等物质中的原子不都满足8电子结构;原子半径的大小比较可以借助于元素周期表的递变规律进行比较,即同同期从左到右随核电荷数的增大,原子半径逐渐减小,同主族元素从上到下随核电荷数的增大,原子半径逐渐增大;具有相同电子层结构的阴、阳离子随核电荷数的增大,离子半径逐渐减小。
考点2:化学平衡的标志及等效平衡
例2、向某密闭容器中充入1mol CO和2mol H2O(g),发生反应: 。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5 mol CO+2mol H2O(g)+1mol CO2+1mol H2
B.1mol CO+1mol H2O(g)+1mol CO2+1mol H2
C.0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4mol H2
D.0.5mol CO+1.5mol H2O(g)+0.5mol CO2+0.5mol H2
解题思路:
根据同温同体积下,反应前后气体体积相等的反应,只要符合相同的物质的量之比,即可达到等效平衡。A中,全部物质通过极值转换到左边为1.5 mol CO+3mol H2O(g),因此达平衡时CO的体积分数为x;B中,换算到左边为2mol CO+2mol H2O(g),可理解成1mol CO和2mol H2O(g)达平衡后,再充入1mol CO,CO的体积分数变大;C中,换算到左边为0.9mol CO+1.9mol H2O(g),如果是0.9mol CO+1.8mol H2O(g)与题干的平衡是等效平衡,再向其中充入0.1mol H2O,平衡右移,CO的体积分数减小;D中,换算到左边为1mol CO和2mol H2O(g),平衡时CO的体积分数为x。答案:B
点评:做好此类题,一要掌握判断等效平衡的方法;二要学会运用极值转换的方法来分析、解决问题。
考点3:弱电解质的电离平衡
例3、25℃时,水的电离达到平衡:H2O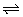 H++OH-;△H>0,下列叙述正确的是( )
H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
解题思路:
向水中加入稀氨水,平衡向左移动,由于氨水本身电离出OH-,使c(OH-)增大,A错误;CH3COO-结合水电离出的H+,会促进水的电离,平衡正向移动,使c(OH-)增大,C错误;将水加热,KW增大,pH变小,D错误。答案:B
点评:解答此类题目的关键是要正确理解有关概念,会运用勒夏特例原理来分析弱电解质的电离情况。这部分高考的难点是对影响电离平衡移动的因素进行综合考查。
考点4:盐类水解
例4、有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
解题思路:
浓度相同的强碱溶液的碱性比强碱弱酸盐溶液的碱性强,又因为CH3COOH酸性强于H2CO3,所以Na2CO3溶液的水解程度大于CH3COONa,故碱性强于CH3COONa溶液,则3种溶液pH的大小顺序是③>①>②,A错误;盐溶液稀释过程中,水解程度加大,pH变化较小,pH变化最大的是NaOH溶液,B错误;若分别加入25mL 0.1mol/L盐酸后,①变成NaHCO3和NaCl混合溶液,仍显碱性,②变成CH3COOH和NaCl的混合溶液显酸性,③为NaCl溶液显中性,C正确;当pH均为9时,NaOH溶液浓度最小,盐对应的酸越弱,盐溶液水解程度越强,pH相同时其对应的浓度越小,则物质的量浓度的大小顺序应是②>①>③,D错误。答案:C。
点评:盐类水解与日常生活、农业生产联系密切,应用性强,是高考的重点。复习时重点要把握盐类水解的实质、规律,盐类水解的化学方程式、离子方程式的书写,运用盐类水解知识解释有关生活中的现象和解决一些生产中遇到的实际问题。
(2)无机框图题——学科主干知识的灵魂
新的考试大纲明确指出通过对学科主干知识的考查了解考生对化学基础知识和基本技能掌握的熟练程度。什么是学科主干知识?元素及其化合物的知识就是化学学科的主干知识,因为化学基本概念、化学三大基本理论都是建立在元素及其化合物知识之上,离开了元素及其化合物的有关知识,化学基本概念、化学三大基本理论就成了“空中楼阁”没有根基。怎样突出学科主干知识呢?在平时学习中要熟记课本上出现的重要化学反应方程式。例如卤素中主干化学反应有:H2+Cl2 2HCl,Cl2+2NaOH=NaCl+NaClO+H2O,MnO2+4HCl(浓)
2HCl,Cl2+2NaOH=NaCl+NaClO+H2O,MnO2+4HCl(浓)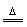 MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氮族元素中主干化学反应有:N2+3H2
MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氮族元素中主干化学反应有:N2+3H2 2NH3,N2+O2
2NH3,N2+O2 2NO,2NO+O2=2NO2,4NH3+5O2
2NO,2NO+O2=2NO2,4NH3+5O2 4NO+6H2O,3NO2+H2O=2HNO3+NO等,高考试题中不论无机框图题怎样命题都不可能脱离课本上主干反应。现以下题为例予以说明框图题怎样考查课本上的学科主干反应。
4NO+6H2O,3NO2+H2O=2HNO3+NO等,高考试题中不论无机框图题怎样命题都不可能脱离课本上主干反应。现以下题为例予以说明框图题怎样考查课本上的学科主干反应。
例5、18世纪中期欧洲人在寻找金矿时发现了一种金光闪闪的黄色矿石B误以为发现了露天金矿,但将矿石B隔绝空气加强热后发现,金光闪闪的矿石B转化为黑色固体A和另一种难溶于水而易溶于CS2的淡黄色单质Q,故后来矿石B被戏称为“愚人金”。实验测得A、B有如下框图所示的转化关系:
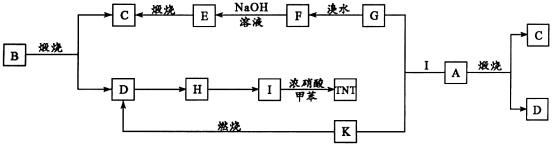
根据上述框图所示的转化关系回答:
(1)写化学式:A:__________;B:__________;
(2)写出高温煅烧A、B的化学反应方程式____________________。
(3)写出下列反应的化学方程式:
K燃烧生成D:____________________________________________
G溶液和溴水反应:________________________________________
(4)用离子反应方程式表示A和K溶液反应生成G和I的过程。
____________________________________________________________。
解析:
硫、铁、卤素等学科主干知识的能力要求属考试大纲规定“综合应用”层次。本题以“愚人金”为命题线索综合了考纲规定应理解和了解知识点:SO2的工业制法、Br2的氧化性、H2S的可燃性、硫酸的工业制法,综合考核考生阅读信息、获得解题切入点的自学能力和学科综合能力。解答本题可从如下几点展开思路。
(1)B是一种金光闪闪的矿石,B隔绝空气加强热生成黑色固体A和不溶于水而易溶于CS2的黄色单质Q可知Q是硫,由矿石信息可作如下假设:FeS2 FeS+S,然后通过框图转化关系再加以验证。(2)由框图转化关系
FeS+S,然后通过框图转化关系再加以验证。(2)由框图转化关系 可推出A、B组成元素相同,与(1)假设相符,故推出A是FeS2,B是FeS则全题可迎刃而解。
可推出A、B组成元素相同,与(1)假设相符,故推出A是FeS2,B是FeS则全题可迎刃而解。
答案:
(1)A:FeS;B:FeS2
(2)4FeS+7O2 2Fe2O3+4SO2;4FeS2+11O2
2Fe2O3+4SO2;4FeS2+11O2 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(3)2H2S+3O2 2SO2+2H2O;6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3;
2SO2+2H2O;6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3;
(4)FeS+2H+=Fe2++H2S↑
(3)有机化学一一高考试题中的“黑马”
自高考科目改革以来,不论是理综试卷中的有机化学试题,还是化学单科中有机化学试题,总是以“鹤立鸡群”之势“独傲群芳”,故被称为高考化学试卷中的“黑马”。在综合训练复习中怎样才能“驯服”这匹“黑马”呢?“熟悉转化规律,切中解题关键”这就是解有机化学题的秘诀,现以例6予以说明。
例6、下图中A、B、C、D、E、F、G均为有机化合物。
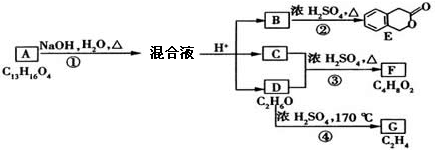
根据上图回答问题:
(1)D的化学名称是__________。
(2)反应③的化学方程式是__________。(有机物须用结构简式表示)
(3)B的分子式是__________。A的结构简式是__________。反应①的反应类型是__________。
(4)符合下列3个条件的B的同分异构体的数目有__________个。
i)含有邻二取代苯环结构ii)与B有相同官能团iii)不与FeCl3溶液发生显色反应
写出其中任意一个同分异构体的结构简式____________________。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途:
____________________________________________________________。
解题思路:
本题解题思路是通过反应条件及官能团的性质确定有机物结构。
(1)联系D的分子式C2H6O,G的分子式C2H4,D→G的反应条件浓H2SO4、170℃,可以确定④为乙醇的消去反应,由此可得出D是CH3CH2OH,G是CH2=CH2。
(2)结合F的分子式和D(CH3CH2OH),以及反应条件浓H2SO4、△,可知反应③为酯化反应,根据化学式可推出C是CH3COOH。
(3)由E的结构简式及B→E反应条件浓H2SO4、△,可知B发生分子内酯化,B结构简式为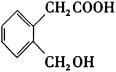 。通过对酯的水解原理的把握,结合B、C、D的结构简式和反应条件,反推出A的结构简式为
。通过对酯的水解原理的把握,结合B、C、D的结构简式和反应条件,反推出A的结构简式为 。
。
(4)根据书写同分异构体的要求:官能团种类与取代基位置不变,只能变换取代基上碳原子的数目及官能团的位置。如果—CH2COOH减少一个碳原子变为—COOH时,另一个取代基就要增加一个碳原子,就有两种结构 和
和 ,如果再将官能团变换一下位置就是
,如果再将官能团变换一下位置就是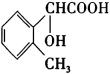 。
。
(5)乙烯是重要的工业原料,主要用于制造塑料、合成纤维、有机溶剂等。
答案:
(1)乙醇
(2)CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(3)C9H10O3; ;水解反应
;水解反应
(4)3 (填写其中一个结构简式即可)
(填写其中一个结构简式即可)
(5)CH2=CH2+H2O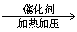 CH3CH2OH或nCH2=CH2
CH3CH2OH或nCH2=CH2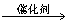
 n。(写任一个合理的反应式均可)
n。(写任一个合理的反应式均可)
点评:烃的衍生物知识是高考有机化学中的重要部分。分析反应的特点,熟悉各种烃的衍生物的官能团性质及反应条件是解题的关键。
2、要点复习的策略及技巧
(1)识图看表一一功在平时
与文字相比,用图、表描述自然科学的研究成果具有直观形象的特点,因此看懂图、表所包含的信息,能从文字、图、表中提取所需的信息,并从中找出规律,是当前高考对考生能力方面提出的一个重要要求。近几年来高考理综试题和化学单科对考生识图看表能力的考查主要是从两方面进行的:能从图、表中提取所需信息的能力。统计表明,2007年试题中的图表数较2006、2007年又有所增加,共有图、表17个,这还不包括化学试题中复杂无机物、有机物的结构示意图。这些图、表有的是包含着重要的解题信息,有的则是给问题的解决以直观的提示。
“定量描述自然科学的现象和规律。包括用数学知识处理物理问题、化学计算,以及用简单的图表和数据描述生命活动的特征等”是《考试大纲》对考生提出的一项新要求,并在2007年高考试题中得到了具体体现,因此在复习备考阶段应对涉及图、表类学科内综合题加大训练力度。
例7、有甲、乙、丙三种常见短周期元素,它们之间两两化合可生成化合物戊、己、庚。化合物戊、己、庚之间也能相互反应,巳知戊是由甲和乙两元素按原子个数1︰1组成的化合物,甲、乙、丙三元素形成的单质(仍用甲、乙、丙表示)和它们组成的化合物之间的反应关系如下(未配平)
①乙+丙→己 ②甲+丙→庚 ③戊+己→丁
④戊+庚→丙+辛 ⑤己+庚→丙+辛
若丁的用途如下图所示,试解答下列问题:
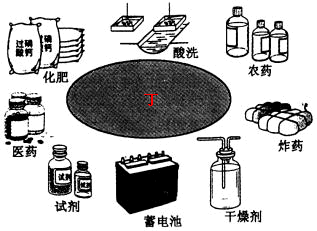
(1)写出下列物质的化学式:
已:____________________;
庚:____________________;
丁:____________________。
(2)写出下列反应的化学方程式:
反应③:____________________;
反应④:____________________。
(3)298K时VL真空容器内通入n mol己和m mol庚。
①若n=2则当m=__________时,反应后容器内气体的密度最小。
②若2n>m则反应后氧化产物与还原产物的质量差为__________g。
③若5n=m则反应后氧化产物与还原产物的质量和为48g,则n+m=__________。
解析:
由丁的用途图可知丁为硫酸,据此按题给信息可倒推出戊是SO3,己是H2O,但这与题目中所述戊是由甲和乙按原子个数1︰1组成的化合物相矛盾,故退而假设戊为H2O2,则己为SO2,H2O2有氧化性,SO2具还原性,两者反应生成H2SO4:H2O2+SO2=H2SO4符合题意,此为全题突破口之所在。据此可推知:甲:氢元素或H2;乙:氧元素或O2,丙:S;丁:H2SO4;戊:H2O2;己:SO2;庚:H2S;辛:H2O;各步反应为:①O2+S=SO2,②H2+S=H2S,③H2O2+SO2=H2SO4,④H2O2+H2S=S+2H2O,⑤SO2+2H2S=3S+2H2O。(3)①当真空容器内H2S和SO2恰好完全反应时气体密度最小为0,即
2H2S + SO2 = 3S↓ + 2H2O
m 2m
故有:m=2n=4
②由2n>m可推出:n︰m>2︰1,即SO2过量,H2S完全反应:
SO2+ 2H2S =2S + S + 2H2O
 m m
m m 
故氧化产物与还原产物质量差为:
③由5n=m可推出:n︰m=n︰5n=1︰5<1︰2,即H2S过量,SO2完全反应,氧化产物与还原产物总的物质的量为:3n mol,则3n×32=48n=0.5,故:n+m=6n=3
答案:
(1)己:SO2;庚:H2S;丁:H2SO4
(2)③H2O2+SO2=H2SO4 ④H2O2+H2S=S+2H2O
(3)①4;②16mg;③3
(2)曲径通幽——化学计算
化学计算一直是高考化学试卷中的一颗明珠,是理科考生“攀蟾折桂”的“曲径”,怎样在综合训练阶段“曲径通幽”呢?
数学作为人类思维的表达形式,反映了人类积极进取的意志,缜密周详的推理,以及对完美境界的追求,显然数学除具有思维训练的科学理性价值和功能价值外,还具有美学价值。化学作为自身的发展和需要与数学有着紧密的联系。《考试大纲》在能力和能力品质中要求:将化学问题抽象为数学问题利用数学工具通过计算和推理(结合化学知识)解决化学问题的能力,因此要求我们在选题时要善于把握、挖掘选择化学中合理的可利用数学因素,让考生了解尝试、体验用数学手段处理化学问题的方法、技巧和能力。
例8、已知固体混合物A由NaHCO3、KHCO3、MgCO3和CaCO3四种物质中的两种混合而成,这四种物质的摩尔质量分别为M(NaHCO3)=84g·mol-1,M(KHCO3)=100g·mol-1,M(MgCO3)=84g·mol-1,M(CaCO3)=100g·mol-1。通过计算和推理回答下列问题。
(1)取A与足量的盐酸反应:
①若n(A)为定值,生成气体的量即为定值,则A的组成可能有________种。
②若m(A)为定值,生成气体的量即为定值,则A的组成可能是(可以不填满,也可补充)
(2)若先将A加热至不产生气体,剩余固体再与足量的盐酸反应,先后两次产生的气体分别通过足量的澄清的石灰水生成的沉淀的质量均为10.0g,则m(A)的取值范围为________。
解析:
1、①共6种
②Mr=100有:KHCO3、CaCO3
Mr=84有:MgCO3、NaHCO3
③由题意知混和物只能是碳酸氢盐即混和物为NaHCO3和KHCO3组成,令m(NaHCO3)趋近于0,则m(A)有极大值20.0g令m(KHCO3)趋近于0则m(A)有极小值16.8g故16.8<m(A)<20.
答案:
(1)①6
②如下表
| |
(Ⅰ) |
(Ⅱ) |
(Ⅲ) |
A的组成 |
MgCO3、NaHCO3 |
CaCO3、KHCO3 |
|
(2)16.8g<m(A)<20g
点评:近年来对高考计算能力的考查重点不在对考生数学计算技巧的考查,而在考查考生运用数学思想分析和解决化学问题的能力。
(3)理科综合,得实验者得天下
科学实验是理科研究和学习的重要手段,因此,实验能力一直都是理综测试的重要考查内容。2007年理综试题在继续加强实验能力考查的同时,实验命题上还呈现出一个新的特点一一“整体性和一体化”思想,即并不关注单科实验能力考查上的面面俱到,而是从三科整体上来涵盖理科实验所要求考生应具备的能力。也就是说,单从某一学科的实验试题看,试题考查的功能似乎都不够全面,或不够典型;但从整体上看,全卷的实验试题却基本上涵盖了《考试大纲》上所要求的实验能力,表现出理综试题正逐渐整体融合的命题趋势。因此近年来有理科综合得实验者得天下之说。
例9、化学课外活动小组设计了如下图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性。
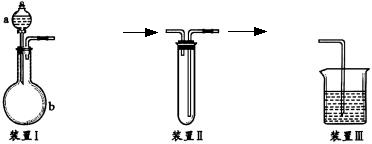
(1)甲同学认为利用装置Ⅱ可直接收集NH3、H2但不能收集O2其理由是:__________________________。
(2)乙同学认为装置Ⅰ可作为实验室氧气的快速发生器,对装置Ⅱ仅作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:________________________;制O2时在装置Ⅰ中的a中加入__________,b仪器中加入__________。
(3)丙同学认为装置Ⅱ经乙改进后只需在装置Ⅱ之后连一尾气吸收装置即可收集SO2气体。试将吸收SO2的尾气吸收装置画在下列方框中。
(4)丁同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2氧化性比Br2强的实验进行此项实验时在装置Ⅰ中的a仪器中加入__________试剂,b仪器中加入__________试剂,装置Ⅲ中应加入__________试荆,根据装置Ⅲ中观察到的__________实验现象即可得出Cl2的氧化性比Br2强的结论。
解析:
本题以考试大纲规定属于“理解”和“综合应用”层次的如下知识点:常用仪器的用途、常见气体实验室制法、实验现象等为核心命题综合考查考生“设计实验、改进实验装置”的能力、能绘制和识别典型实验仪器装置图的能力。解答本题可以从如下三个方面展开思路:
(1)由装置Ⅰ可知该气体发生装置为液——固反应不加热装置利用本装置可制备CO2、H2、O2(用H2O2和MnO2为原料)SO2、H2S、NO、C2H2等。
(2)装置Ⅱ为气体收集装置,若该装置导气管“短进长出”,则可收集H2、NH3、CH4等比空气轻的气体,若将导气管改为“长进短出”则可收集比空气重的气体如O2、SO2、Cl2、HCl等。
(3)装置Ⅲ既可作尾气吸收装置又可作反应器,解题时抓住上述三点,再紧扣“探研该装置用途的多功能性”进行思考则全题可解。
答案:
(1)因为H2、NH3比空气轻而O2比空气重
(2)把装置Ⅱ中的进气导管改为长导管插至试管底部,出气导管管口应与胶塞相平,即所谓“长进短出”;3%的H2O2溶液;少量MnO2粉末
(3)如下图

(4)浓盐酸;KMnO4;NaBr溶液;溶液由无色变橙色;
关注能力及能力品质的考查是高考永恒的主题,2005年高考试题回归教材、回归基础的特点启示我们,在备考复习阶段一定要降低复习重心,淡化“热点”,踏踏实实地完成课本学习任务,全面落实考试大纲的要求,对考纲规定的每一个知识点都要认真把握其内涵和外延,形成坚实、完整的知识体系,这样才能在今后的高考中立于不败之地。最后,在结束前为培养自己良好心理素质,希望同学们在平时复习考试过程中“怀一颗平常心,宠辱不惊,看厅前花开花落;去留无意;看天上云卷云舒,皆是白云苍狗”,只有做到这样才能夺得高考最后的胜利。
1、选择题——考查三大理论的主旋律
考点1:对物质结构理论的综合考查
例1、下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol  中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
解题思路:
CH2Cl2属于四面体结构的极性分子,C错。答案:C
点评:从《考试大纲》来看,有关物质的空间结构和晶体部分的内容要求有所降低,复习过程中应对课本中出现的几种晶体结构有所掌握:如NH3的空间结构、CH4、P4、NaCl、CsCl、石墨、金刚石、SiO2的结构等。
考点2:利用图象对化学反应速率与化学平衡的考查
例2、对于可逆反应:A2(g)+3B2(g)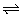 2AB3(g);△H<0,下列图像中正确的是( )
2AB3(g);△H<0,下列图像中正确的是( )

解题思路:
该反应的正反应是放热反应,逆反应是吸热反应,达到平衡后有v正=v逆,升高温度平衡向逆反应方向移动,v正与v逆都增大,但v正增大的倍数小于v(逆)增大的倍数,故A正确。增大压强平衡向正反应方向移动,AB3的物质的量分数(AB3%)增大,但由图象知AB3%随压强增大而减小故B错。在压强一定时升高温度平衡逆移B2%应增大,由图象知,B2的物质的量分数(B2%)减小,故C不正确。在压强一定时温度越高达到平衡所用时间越短;温度越低达到平衡所用时间越长。故D不正确。答案:A
技巧点拨:改变外界条件对化学反应速率及化学平衡的影响,可用各种图像来表示,解答图像题目的方法思路是:(1)看懂图像:一看面(即看清横坐标和纵坐标),二看线(即看线的走向、变化的趋势),三看点(即看线是否通过原点,两条线的交点及线的拐点),四看要不要作辅助线(如等温线、等压线),五看定量图像中有关量的多少。(2)联想规律:即联想外界条件对化学反应速率和化学平衡的影响规律,且熟练掌握。(3)作出判断:认准某些关键数据在解题中的特定作用,全面、准确地从图中找出直接或隐含的相关解题信息。
考点3:对电离平衡的综合考查
例3、草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10mL 0.0lmol/L NaHC2O4溶液中滴加0.0l mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=1×10-2mol/L
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D.V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
解题思路:
NaHC2O4是中强酸的酸式盐,因为电离程度大于水解程度,所以溶液显酸性,因HC2O4-不完全电离,所以c(H+)不可能为1×10-2mol/L,A错误;0<V(NaOH)<10mL时,溶质为NaHC2O4和Na2C2O4,根据电荷守恒得:c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),V(NaOH)=10mL时,溶质为Na2C2O4,溶液显碱性,从0滴加到10mL,溶液由酸性经过中性,到碱性,当中性时c(H+)=c(OH-),得出c(Na+)=2c(C2O42-)+c(HC2O4-),B错误;V(NaOH)=10mL时,溶质为Na2C2O4,溶液显碱性,c(H+)<1×10-7mol/L,C错误;V(NaOH)>10mL时,溶质为NaOH和Na2C2O4,D正确。答案:D
点评:本题考查中和滴定过程中各阶段的离子浓度大小、酸碱性等,将盐类水解与弱电解质的电离、三大守恒原理、酸碱中和滴定、溶液pH等融合在一起,具有一定的综合性。
考点4:对氧化还原反应的综合考查
例4、已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
A.10mol B.11mol
C.12mol D.13mol
解题思路:
首先根据题意判断Cu(IO3)2是氧化剂,再分析反应前后铜、碘两种元素化合价变化情况。Cu(IO3)2中Cu由+2价变为+1价,得到1个电子,I由+5价变为0价(注意:同种元素不同价态之间发生氧化还原反应遵循“只靠拢不相交”规律),共得到2×5e-,则1 mol Cu(IO3)2在反应中得到的电子为11mol。答案:B
点评:这是一道有关氧化还原反应的基本概念及基本规律运用的试题,认真审题,正确判断氧化剂、还原剂是解答此类试题的关键。本题应注意的一个问题是:Cu(IO3)2中的+5价I和KI中的部分-1价I都转化为I2,而生成物CuI中的I-来自于KI中价态没有发生变化的I-,遵循同种元素不同价态之间发生氧化还原反应“只靠拢不相交”规律。
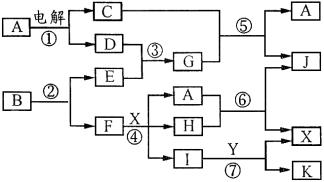
例5、下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出下列物质的化学式:A.__________,E.__________,F.__________,Y.__________。
(2)反应⑤的化学方程式为:______________________________。
(3)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为____________________。
解析:
(1)由G为极易溶于水的碱性气体,知G为NH3,又D+E→NH3,且A(无色液体) D+C,知D为H2(因电解液体时不可能得到N2),E为N2;又C+NH3→A+J,则C为O2,A为H2O,J为NO;因Y是胃酸的重要成分,则Y为HCl,又I+HCl→X+K(K是不溶于稀HNO3的白色沉淀),则K为AgCl,X为酸且物质Ⅰ中含有Ag+;又由反应⑤4NH3+5O2
D+C,知D为H2(因电解液体时不可能得到N2),E为N2;又C+NH3→A+J,则C为O2,A为H2O,J为NO;因Y是胃酸的重要成分,则Y为HCl,又I+HCl→X+K(K是不溶于稀HNO3的白色沉淀),则K为AgCl,X为酸且物质Ⅰ中含有Ag+;又由反应⑤4NH3+5O2 4NO+6H2O是制备X的主要反应之一,所以X为HNO3,则Ⅰ为AgNO3;而H+H2O→HNO3+NO,则H为NO2;又F+HNO3→AgNO3+NO2+H2O,所以F为Ag。
4NO+6H2O是制备X的主要反应之一,所以X为HNO3,则Ⅰ为AgNO3;而H+H2O→HNO3+NO,则H为NO2;又F+HNO3→AgNO3+NO2+H2O,所以F为Ag。
(3)因B→N2+Ag,故B中只含N和Ag两种元素,根据B中Ag的质量分数为72%,且B的化学式为AgNn,则有 ,B的化学式为AgN3。
,B的化学式为AgN3。
答案:
(1)H2O N2 AgHCl
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)AgN3
例6、为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U形管下部有少量液体X,集气瓶中收集到无色气体Y。如图:

回答下面问题:
(1)在装置中试管和U形管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是_____________________________________________。
(2)液体X可能是__________;气体Y可能是__________。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上:
应注意__________________________________________________。
理由是__________________________________________________。
(4)用简单的实验证实(2)中的判断:
①对X的判断;
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)。
解析:
解此题的两个关键知识点是:①2Pb(NO3)2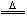 2PbO+4NO2+O2,②2NO2
2PbO+4NO2+O2,②2NO2 N2O4。由此可知X为N2O4,Y为O2。
N2O4。由此可知X为N2O4,Y为O2。
(1)因NO2气体容易腐蚀橡胶,因此橡皮塞应用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠。
(2)气体Y用排水法收集,停止反应时,应先从水槽中抽出导气管,再熄灭火焰,这样做是为了防止倒吸。
(3)实际上是NO2和O2的检验。NO2在气态时呈红棕色,因而最简单的方法是取出U形管,液体汽化后呈红棕色,表明液体X为液态NO2;O2的检验可用带火星的木条但要按题目要求来回答有关步骤等。
答案:
(1)NO2气体会损坏橡胶
(2)N2O4(答液态的NO2同样给分); O2
(3)先把导气管移出水面,然后熄灭火焰防止水槽中水倒吸到U形管中
(4)①在通风橱中取下U形管放置,观察到U形管中液体迅速消失,管中充满红棕色气体,证明X是液态N2O4。
②在水槽中,用玻璃片盖住集气瓶口,按住玻璃片,小心集气瓶移出水面,正放在桌上,用带火星的木条插入瓶中木条迅速燃烧,证明Y是O2。
例7、奶油中有一种只含C、H、O的化合物A。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2︰4︰l。
(1)A的分子式为____________________。
(2)写出与A分子式相同的所有酯的结构简式:__________________________。
已知:①ROH+HBr(氢溴酸)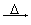 RBr+H2O
RBr+H2O
②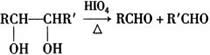
A中含有碳氧双键,与A相关的反应如下:
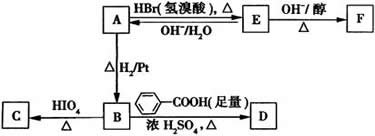
(3)写出A→E、E→F的反应类型:A→E__________、E→F________。
(4)写出A、C、F的结构简式:A__________、C__________、F__________。
(5)写出B→D反应的化学方程式:____________________。
(6)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:____________________。A→G的反应类型为____________________。
解题思路:
(1)可设A的化学式为(C2H4O)x,结合A的相对分子质量为88,得x=2,A的分子式为C4H8O2。
(2)A中有四个碳原子,当醇为甲醇时,酸为丙酸,两者不存在同分异构体,酯为丙酸甲酯;当醇为乙醇时,酸为乙酸,酯为乙酸乙酯;当醇为丙醇时,有两种同分异构体符合: HCOOCH2CH2CH3、HCOOCH
(3)结合题示信息中的反应,A与HBr反应,说明A中含有碳氧双键的同时,还含有羟基,A与H2加成生成B,B能与HIO4反应,说明碳氧双键与羟基相连的碳原子相邻,B与HIO4反应只得到C一种产物,说明B是结构对称的有机物,A的结构简式应为 ,与氢气加成得B:
,与氢气加成得B: ,A与HBr发生取代反应得到E:
,A与HBr发生取代反应得到E: ,E发生消去反应得到F:
,E发生消去反应得到F: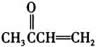 。
。
(4)结合题中信息可知,B与HIO4反应得到CH3CHO。
(5)结合反应条件:B与苯甲酸浓H2SO4共热发生酯化反应。
(6)G的相对分子质量比A少2,说明G比B少两个氢原子,一氯代物只有一种,G整个分子应该是对称的,也说明A发生氧化,形成1个碳氧双键。
答案:
(1)C4H8O2
(2)CH3CH2COOCH3 CH3COOCH2CH3 HCOOCH(CH3)2 HCOOCH2CH2CH3
(3)取代反应 消去反应
(4) CH3CHO
CH3CHO 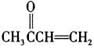
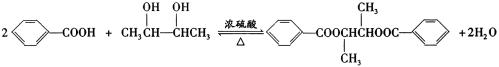
(5)
(6) 氧化反应
氧化反应
点评:有机合成与推断是以有机化学知识和技能为基础,通过对题示信息、实验现象、有机结构的分析,合成或推断出指定的有机物。解题的关键在于准确把握题示信息,找出题中的有效信息和隐含信息,剔除无效信息和干扰信息。