(一)复习要点阐述
1、钠及其化合物之间的相互转化关系
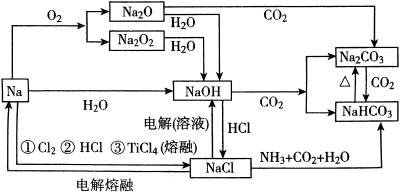

(二)要点复习的策略及技巧
1、金属钠
(1)钠的物理性质
钠是一种质软、具银白色光泽的金属,具有良好的导电、导热性,密度为0.97g·cm-3,比水小,比煤油大,熔点为97.81℃。
(2)钠的化学性质
①与非金属反应:

②与水反应:
2Na+2H2O=2NaOH+H2↑
③与盐酸反应:
2Na+2H+=2Na++H2↑
④与盐溶液反应
钠与盐溶液反应,Na先与水反应生成NaOH,生成的NaOH再和盐反应。
投入NaCl溶液中,只有H2放出。
2Na+2H2O=2NaOH+H2↑
投入饱和NaCl溶液中,有H2放出,还有NaCl晶体析出(温度不变)。
投入NH4Cl溶液中,有H2和NH3逸出。

投入CuSO4溶液中,有H2放出和蓝色沉淀生成。
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
⑤金属和溶液换反应的规律:

(3)钠的保存、制取及用途
(1)保存:由于金属钠的化学性质非常活泼,易与空气中的O2和H2O等反应,所以金属钠要保存于煤油中。
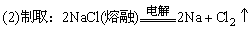
(3)用途:①工业上利用Na的强还原性,用于冶炼金属,如: ②Na-K合金(液态)用作原子反应堆的导热剂。③在电光源上,用钠制造高压钠灯。
②Na-K合金(液态)用作原子反应堆的导热剂。③在电光源上,用钠制造高压钠灯。
2、钠的化合物
(1)氧化钠和过氧化钠的性质
①氧化钠:白色固体,碱性氧化物,露置在空气中易被氧化成Na2O2:2Na2O+O2=2Na2O2。这是工业上制备Na2O2的方法之一。
②过氧化钠:淡黄色固体。过氧化钠电子式为:
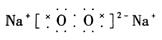
过氧化物:含有—O—O—键的化合物叫过氧化物。例如:Na2O2、BaO2、H2O2等属于过氧化物,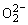 中氧的化合价为-1。过氧化物性质大多不稳定,有强氧化性。
中氧的化合价为-1。过氧化物性质大多不稳定,有强氧化性。
过氧化钠常用作供氧剂:
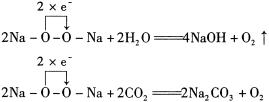
在上述氧化还原反应中,Na2O2既是氧化剂又是还原剂。Na2O2可视作H2O2对应的盐。H2O2具有弱酸性,H2O2的稀溶液可用于实验室快速制备氧气:
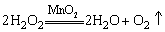
(2)碳酸钠和碳酸氢钠
①NaHCO3既能跟酸反应,又能跟碱反应。
NaHCO3+HCl=NaCl+CO2↑+H2O
NaHCO3+NaOH=Na2CO3+H2O
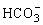 既能接受质子又能放出质子,因此
既能接受质子又能放出质子,因此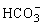 既是碱又是酸。
既是碱又是酸。
②利用NaHCO3受热分解产生的气体能使澄清石灰水变浑浊的实验现象可区别NaHCO3和Na2CO3两种白色固体。
③NaHCO3和Na2CO3相互转变
Na2CO3和NaHCO3可在一定条件下相互转化:
溶液中:NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+CO2+H2O=2NaHCO3
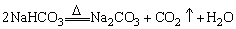
(3)侯德榜制碱法
①原料:食盐、氨、二氧化碳和水
②反应原理:
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
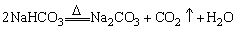
(4)氢氧化钠
①氢氧化钠的物理性质:白色固体,有强吸水性,易潮解,可用作干燥剂。一般将氢氧化钠和生石灰按一定比例熔融制成的干燥剂碱石灰。
②氢氧化钠的化学性质:强碱,具有碱的通性。
CO2与NaOH溶液反应:
2NaOH+CO2=Na2CO3+H2O
当CO2过量时生成NaHCO3:
NaOH+CO2=NaHCO3
③氢氧化钠的工业制法:

纯碱法:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
④氢氧化钠的保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞,因为烧碱能与玻璃中的SiO2发生反应:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3使玻璃塞黏结。
3、碱金属元素
(1)周期表中的位置:

②相似性:a.最高正价为+1价;b.氧化物对应水化物为强碱,典型的活泼金属元素;c.同类物质结构及性质相似。
③递变性(随着原子序数递增)原子半径由小到大;元素的金属性逐渐增强;最高氧化物对应水化物的碱性逐渐增强;单质的熔沸点逐渐降低。
(2)碱金属的化学性质
①跟卤素反应——生成卤化物。
②跟氧气反应——生成氧化物、过氧化物等。碱金属都能跟氧气直接化合生成氧化物。除锂之外,其他碱金属还能跟氧气反应生成过氧化物,钾、铷等还能跟氧气反应生成更复杂的氧化物,如超氧化钾KO2,说明它们的性质存在异同点。
③跟水反应——生成氢氧化物同时放出氢气,碱金属元素随着核电荷数的增加,跟水反应的剧烈程度也随之增加。
焰色反应是指多种金属或它们的化合物灼烧时使火焰呈现特殊颜色的现象。在此过程中没有新物质生成,只有电子能量的变化产生的不同波长的光,是金属或它们化合物的特征颜色,是一种物理现象,主要用于Na、K等碱金属及其离子的检验。
(3)碱金属的制取
金属Li和Na主要是用电解熔融氯化物的方法制取,如:
金属钾工业上常用Na从熔融KCl中将其置换出来: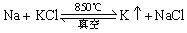 。
。
置换出的钾由于密度比钠小,故浮在熔融液上面。同时,由于钾的沸点比钠低,在850℃时,钾变为蒸气挥发出来,而钠还未被气化。根据化学平衡移动原理,钾的挥发导致产物浓度减小,故平衡右移,直至反应完全。
铷和铯的金属性更强,电解熔融盐类时,收集金属更困难;另一方面,铷和铯的沸点更低(分别为688℃和678.4℃),有利于在气态时收集,故工业上常用活泼金属还原法制取Rb和Cs,如:
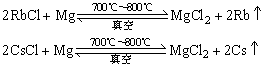
(4)重要碱金属单质保存方法
钠、钾均保存在煤油中;锂的密度(0.534g·cm-3)小于煤油的密度(0.78g·cm-3),它不能浸没在煤油中,因此锂应保存在密度更小的石蜡中。
例1、在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol·L-1的HCl溶液中和,则该生成物的成份是( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
解析:
由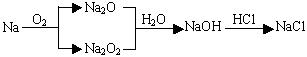 知,
知,
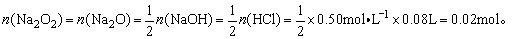
(1)若生成物全部是Na2O则m(Na2O)=0.02mol×62g·mol-1=1.24g,现生成物为1.5g知不全是Na2O。
(2)若生成物全部是Na2O2则m(Na2O2)=0.02mol×78g·mol-1=1.56g>1.5g知生成物不全是Na2O2。
综上所述1.5g生成物只可能是Na2O和Na2O2组成的混和物。
答案:C
例2、在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为p1。若保持容器的体积不变,加入足量的Na2O2,充分振荡并反复用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为p2。则p1和p2之间的关系是( )
A.p1=8p2 B.p1=4p2
C.p1=2p2 D.p1=p2
解析:
①求反应前密闭容器中CO2和CO物质的量之比为多少?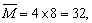 用十字交叉法求:
用十字交叉法求:
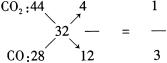 设反应前CO2为1mol,则CO为3mol,则反应前气体物质的量之和为4mol。
设反应前CO2为1mol,则CO为3mol,则反应前气体物质的量之和为4mol。
②求反应后残留气体物质的量。由题意知反应后一定有气体残留,该气体不可能为CO2和CO(因电火花点燃,Na2O2过量),只可能为O2,这O2从何而来?由下式而来:
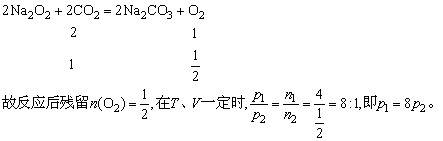
答案:A
例3、在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞(如图所示),充分反应后,气球的变化有三种情况:
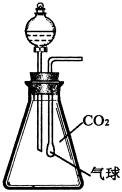
(1)若气球体积不变,则锥形瓶中溶质为__________;
(2)若气球膨胀,则锥形瓶中溶质为__________;
(3)若气球凹瘪,则锥形瓶中溶质为__________。
解析:
锥形瓶内可能发生的化学反应为:
2Na+2H2O=2NaOH+H2↑ ①
2NaOH+CO2=Na2CO3+H2O ②
Na2CO3+CO2+H2O=2NaHCO3 ③
(1)若气球体积不变说明V(H2)=V(CO2),则发生反应为①②,则溶质为Na2CO3。
(2)若气球膨胀说明消耗的CO2体积大于生成H2的体积,可能发生的反应为①②③,则溶质可能为Na2CO3和NaHCO3或NaHCO3。
(3)当气球凹瘪时V(H2)>V(CO2)则发生反应为①②,则溶质为NaOH和Na2CO3。
例4、我国化学家侯德榜(下图)改革国外纯碱生产工艺,生产流程可简要表示如下:
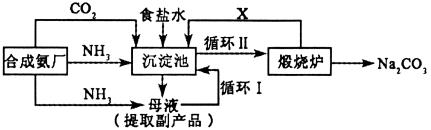
(1)上述生产纯碱的方法称__________,副产品的一种用途为__________。
(2)沉淀池中发生的化学反应方程式是____________________。

(3)写出上述流程中X物质的分子式__________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________ (填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是__________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有__________。
(a)增大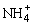 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
解析:
(1)侯德榜针对苏尔维法生产纯碱时食盐利用率低,副产品CaCl2难以处理等不足,在苏尔维制碱法的基础上侯德榜先生经过大量的试验在1943年研究成功了联合制碱法也称侯德傍制碱法,其副产品NH4Cl可作化肥亦可作金属焊接的焊药。
(2)沉淀池中发生反应的化学方程式为:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,由于NaHCO3的溶解度较小,故上述复分解反应能发生。
(3)煅烧炉中发生反应的化学方程式为: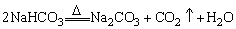 生成的CO2可送入沉淀池中循环使用,因此X是CO2。
生成的CO2可送入沉淀池中循环使用,因此X是CO2。
(4)从沉淀池中滤出的母液中主要成分是NaCl,经氨化后又送入沉淀池中反应称之为循环Ⅰ,循环Ⅰ是提高NaCl利用率的有效措施。从沉淀池中提取沉淀的操作叫过滤。
(5)为检验Na2CO3产品是否含有NaCl可取样品少量溶于水先加足量稀HNO3酸化以排除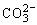 的干扰,再加AgNO3溶液,若生成白色沉淀,则说明样品中含NaCl,反之则不含NaCl。
的干扰,再加AgNO3溶液,若生成白色沉淀,则说明样品中含NaCl,反之则不含NaCl。
(6)因为母液中存在的NaHCO3在提纯NH4Cl的过程中因其溶解度较小易在NH4Cl析出的过程中同时析出使NH4Cl晶体不纯为提纯NH4Cl常通入NH3使杂质NaHCO3转化为易溶的Na2CO3,这是因为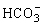 在溶液中存在如下电离平衡:
在溶液中存在如下电离平衡: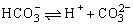 ,当通入NH3后发生如下反应:
,当通入NH3后发生如下反应: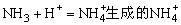 ,既有利于NH4Cl的析出又打破了
,既有利于NH4Cl的析出又打破了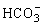 的电离平衡使溶液中
的电离平衡使溶液中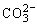 浓度增大使溶解度较小的NaHCO3转化为溶解度较大的Na2CO3在NH4Cl晶体析出过程中所含NaHCO3杂质减少,从而使NH4Cl纯度提高。
浓度增大使溶解度较小的NaHCO3转化为溶解度较大的Na2CO3在NH4Cl晶体析出过程中所含NaHCO3杂质减少,从而使NH4Cl纯度提高。
答案:
(1)联合制碱法或侯德榜制碱法;化肥或电解液或焊药等
(2)NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓
(3)CO2
(4)Ⅰ;过滤
(5)稀硝酸和硝酸银溶液
(6)a、c
例5、向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发所得溶液,得到了白色固体。
(1)CO2的通入量不同,得到的白色固体的组成也不同。试推断有几种可能的组成,并分别列出。
(2)通入2.24L(标准状况下)CO2气体时,得到了11.9g白色固体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
解析:
多元酸和碱反应,如果酸过量则生成酸式盐,碱过量则生成正盐,但通常随着酸、碱物质的量不同生成产物往往有多种。
(1)①当CO2极少KOH过量时,生成物即白色固体是K2CO3,和尚未反应的溶质KOH;
②当二者恰好完全反应,白色生成物即白色固体是K2CO3;
③当CO2和KOH按物质的量1︰1反应时,生成物即白色固体是KHCO3;
④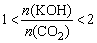 时,白色固体是K2CO3和KHCO3的混合物。
时,白色固体是K2CO3和KHCO3的混合物。
(2)假设全部生成K2CO3,则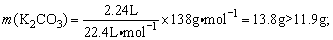 若全部生成KHCO3,则m(KHCO3)=0.1mol×100g·mol-1=10.0g<11.9g,所以11.9g白色固体应是K2CO3和KHCO3的混合物。
若全部生成KHCO3,则m(KHCO3)=0.1mol×100g·mol-1=10.0g<11.9g,所以11.9g白色固体应是K2CO3和KHCO3的混合物。
设白色固体中K2CO3、KHCO3的物质的量分别为x、y,则依
CO2+2KOH=K2CO3+H2O
x 2x x
CO2+KOH=KHCO3
y y y
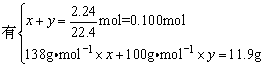
解之,x=0.0500mol,y=0.0500mol,即11.9g白色固体中,
m(K2CO3)=138g·mol-1×0.0500mol=6.90g
m(KHCO3)=100g·mol-1×0.0500mol=5.00g
n(KOH)=2×0.0500mol+0.0500mol=0.15mol
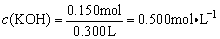
例6、在一定条件下,下列物质间可发生下图所示的转化。
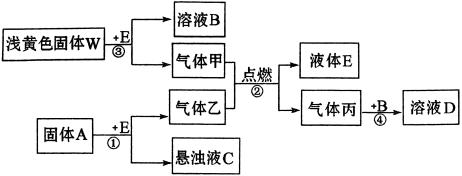
请填空:
(1)若气体乙常用于气割和气焊,则反应①的化学方程式为________________________,将气体丙通入溶液B中,离子反应方程式为________________________。
(2)若固体A是一种盐,由第三周期的两种元素组成,它与水剧烈反应生成的C和乙的物质的量之比为2︰3,则A的化学式为__________。如甲与乙按照反应②恰好能完全反应,则参加反应的W与A的物质的量之比为__________。
解析:
本题的突破点为气体乙常用于气割和气焊易知气体乙是C2H2,据此可推知气体甲是O2,则反应②化学方程式是: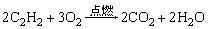 ;由W+E→B+O2且W为浅黄色固体易知W为Na2O2,固体A为CaC2,E为H2O;若固体A是一种盐由第三周期的两种元素组成且能与H2O剧烈反应生成的C和乙物质的量之比为2︰3可知A是Al2S3,若甲(O2)与乙(H2S)按照反应②:2H2S+3O2=2SO2+2H2O反应,则n(W)与n(A)之比可由下式求出:
;由W+E→B+O2且W为浅黄色固体易知W为Na2O2,固体A为CaC2,E为H2O;若固体A是一种盐由第三周期的两种元素组成且能与H2O剧烈反应生成的C和乙物质的量之比为2︰3可知A是Al2S3,若甲(O2)与乙(H2S)按照反应②:2H2S+3O2=2SO2+2H2O反应,则n(W)与n(A)之比可由下式求出:

答案:
(1)CaC2+2H2O→Ca(OH)2+C2H2↑
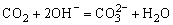
(2)Al2S3 9︰1
例7、钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为__________g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为________。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO2+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L(标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600℃部分分解得到产物A 6.30g。产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
解析:
(1)39.0g钾与10.1g硝酸钾的物质的量分别为1mol,0.1mol。故在反应10K+2KNO3→6K2O+N2中KNO3完全反应,生成K2O的质量应以0.1mol KNO3为计算标准,m(K2O)=0.3mol×94g·mol-1=28.2g。
