(一)复习要点阐述
知识内在联系

(二)要点复习的策略及技巧
1、镁和铝
(1)镁、铝
镁位于元素周期表中第三周期第ⅡA族;铝位于第三周期第ⅢA族。镁原子的最外层有2个价电子;铝原子的最外层有3个价电子。镁和铝都是活泼金属,在化学反应中,都易失去电子而成为金属离子,因而镁和铝的性质有相似之处。但由于原子结构不同,镁和铝的性质也有差异。
例如:镁和铝都是密度较小,熔点也比较低、硬度较小的银白色金属。但镁和铝比较,铝的硬度比镁的稍大,熔、沸点也比镁高,这主要是因为镁和铝的金属键的强弱不同。我们知道铝原子的价电子比镁原子多,它的核电荷数比镁大,而它的原子半径都比镁的小,所以在铝晶体里,自由电子跟铝离子之间的作用比较强,因此铝的硬度比镁的大,熔点和沸点都比镁的高。
(2)镁、铝的化学性质对比
| |
镁的化学性质 |
铝的化学性质 |
与O2反应 |
常温下生成氧化膜,
2Mg+O2 MgO MgO |
常温下生成致密的氧化膜
4Al+3O2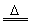 Al2O3 Al2O3 |
与某些非金属反应 |
Mg+Cl2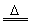 MgCl2 Mg+S MgCl2 Mg+S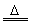 MgS MgS
3Mg+N2 Mg3N2 Mg3N2 |
2Al+3Cl2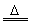 2AlCl3 2AlCl3
2Al+3S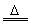 Al2S3 Al2S3 |
与H2O的反应 |
Mg+2H2O Mg(OH)2+H2 Mg(OH)2+H2 |
2Al+3H2O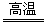 Al2O3+3H2 Al2O3+3H2 |
与某些氧化物反应 |
2Mg+CO2 C+2MgO C+2MgO |
8Al+3Fe3O4 Al2O3+9Fe Al2O3+9Fe |
与非氧化性酸反应 |
Mg+2H+=Mg2++H2↑ |
2Al+6H+=2Al3++3H2↑ |
与碱溶液反应 |
不反应 |
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
(3)氧化镁与氧化铝性质的比较
①相同点:MgO和Al2O3都属于高熔点氧化物,常用作耐火材料。它们都难溶于水。
②不同点:MgO可缓慢与水反应生成Mg(OH)2,而Al2O3不与水反应。MgO是碱性氧化物,只与酸反应,不与碱反应。Al2O3是典型的两性氧化物,即能与酸反应又能与强碱反应。
Al2O3与酸反应生成铝盐:
Al2O3+6HCl=2AlCl3+3H2O
Al2O3与碱反应生成偏铝酸盐:
Al2O3+2NaOH=2NaAlO2+H2O。
(4)氢氧化铝的两性
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=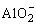 +2H2O
+2H2O
由于Al(OH)3是两性氢氧化物,因此实验室常用铝盐和氨水反应来制备:
Al3++3NH3·H2O=Al(OH)3↓+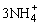
(5)Al3+、Al(OH)3和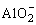 相互转化规律
相互转化规律
①铝盐与碱反应
实验操作 |
往AlCl3溶液中滴加NaOH溶液 |
往NaOH溶液中滴加AlCl3溶液边滴边振荡 |
实验现象 |
先产生沉淀,后沉淀消失 |
产生沉淀,沉淀随即消失得透明澄清溶液后产生沉淀且不消失 |
离子
方程式 |
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-==AlO2-+2H2O |
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
3 AlO2-+Al3++6H2O=4Al(OH)3↓ |
图象 |

|

|
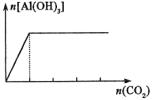
②偏铝酸根与酸反应
实验 |
往NaAlO2溶液中滴加HCl溶液 |
往HCl溶液中滴加NaAlO2溶液边滴边振荡 |
往NaAlO2溶液中通入CO2 |
现象 |
先产生沉淀,后沉淀消失 |
产生沉淀,随即沉淀消失
最后又生成沉淀且不消失 |
产生沉淀且不消失 |
离子
方程式 |
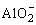 +H++H2O=Al(OH)3↓ +H++H2O=Al(OH)3↓
Al(OH)3+3H+=Al3++3H2O |
AlO2-+H++H2O=Al(OH)3↓
Al(OH)3+3H+=Al3++3H2O
Al3++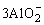 +6H2O +6H2O
=4Al(OH)3↓ |
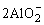 +3H2O+CO2 +3H2O+CO2
=2Al(OH)3↓+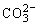
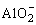 +2H2O+CO2 +2H2O+CO2
= Al(OH)3↓+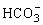 |
图象 |

|
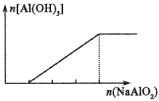
|
|
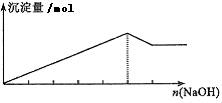
(3)镁盐铝盐的混合溶液与强碱反应
实验 |
往AlCl3和MgCl2的混合溶液中滴加NaOH溶液,边滴边振荡 |
现象 |
先产生沉淀,后沉淀部分溶解 |
离子
方程式 |
Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-= +2H2O +2H2O |
图象 |
 |
(6)镁铝的工业制法
练1、海水的综合利用可以制备金属镁,其流程如下图所示:

(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出有关反应的化学方程式。______________________________________________
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_________________________。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
______________________________________________________
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:____________________________________________________。
过滤时:_____________________________________________________。
蒸发时:____________________________________________________。
解析:
(1)MgCl2·6H2O在空气中加热脱水过程中,MgCl2要水解,生成的HCl气体逸出,使平衡向水解方向移动。不利于得到纯净的MgCl2,若在干燥的HCl气流中使MgCl2·6H2O晶体脱水,HCl气体抑制了MgCl2的水解,加热过程中减少的是水分,最后可得到较纯净的无水MgCl2。
(2)由于Mg(OH)2难溶于水,Ca(OH)2微溶于水,故要除去Mg(OH)2中混有的Ca(OH)2,需加入试剂MgCl2溶液
,使Ca(OH)2转化为易溶于水的钙盐,而不引入新的杂质:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,然后经搅拌、过滤、洗涤即可达到实验目的。
(3)溶解,蒸发时,用玻璃棒搅拌,而过滤时用玻璃棒引流。
答案:
(1)MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑
MgCl2·6H2O MgO+2HCl↑+5H2O↑
MgO+2HCl↑+5H2O↑
或Mg(OH)Cl MgO+HCl↑
MgO+HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水汽,故能得到无水MgCl2。
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤。
(3)搅拌,加速溶解
使滤液沿玻璃棒流入漏斗,防止外洒。
搅拌,防止因局部过热液滴或晶体飞溅。
练2、铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是____________________。
(2)铝与氢氧化钾溶液反应的离子方程式是____________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
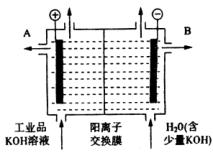
①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因____________________。
③除去杂质后的氢氧化钾溶液从液体出口__________(填写“A”或“B”)导出。
解析:
工业上冶炼铝的主要设备是电解槽,电解槽呈长方形,外面是钢壳内衬耐火砖作为绝缘和保温层用炭块跟它下部的钢导电棒相连结作阴极,用垂直于电解槽带导电杆的两排碳块作阳极,中间是冰晶石—氧化铝熔融体,通电时发生如下反应:
阴极:4Al3++12e-=4Al阳极:6O2-— 12e-=3O2
总反应:2Al2O3 4Al+3O2↑
4Al+3O2↑
在阳极生成的O2立即跟高温下碳块反应:C+O2=CO2
因此,在电解过程中需定期补充Al2O3和碳块。
答案:
(1) 2Al2O3 4Al+3O2↑
4Al+3O2↑
(2)2Al+2OH-+2H2O=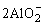 +3H2↑
+3H2↑
(3)①4OH-—4e-=2H2O+O2↑
②通电后H+、K+趋向阴极,H+放电能力比K+强,故H+在阴极放电:2H++2e-=H2↑打破了水的电离平衡使阴极附近c(OH-)>c(H+),故阴极附近溶液pH增大。
③B
2、铁和铁的化合物
(1)铁在周期表中的位置及原子结构
铁位于第四周期第Ⅷ族,属过渡元素。
铁元素是一种变价元素,通常显示+2价、+3价,+2价铁不稳定,易转化为+3价。其化合物及其水溶液往往带有颜色。
(2)金属铁的性质及存在
①物理性质:铁不仅具有金属晶体的物理性质,而且能被磁铁吸引。
②化学性质
a.与非金属反应
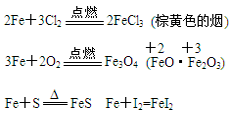
(铁与弱氧化剂反应生成低价铁的化合物)
b.与酸反应
a.和非氧化性酸反应放出H2:Fe+2H+=Fe2++H2↑
b.氧化性酸:常温下浓H2SO4、浓HNO3使铁、铝钝化,故在室温时铁铝不溶于浓H2SO4和浓HCO3。
③与水反应:
3Fe+4H2O(气) Fe3O4+4H2
Fe3O4+4H2
c.铁的存在
铁在自然界中分布较广。在地壳中含量约占5%,仅次于铝。分布在地壳中的铁均以化合态存在,游离态的铁只能在陨石中得到。铁矿石的种类较多,重要的有:赤铁矿(Fe2O3),磁铁矿(Fe3O4),褐铁矿(2Fe2O3·3H2O)和菱铁矿(FeCO3)。
(3)铁的氧化物和氢氧化物
①铁的氧化物
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
俗名 |
- |
铁红 |
磁性氧化铁 |
色态 |
黑色粉末 |
红棕色固体 |
黑色晶体 |
价态 |
+2 |
+3 |
+2价,+3价 |
水溶性 |
不溶 |
不溶 |
不溶 |
与酸的反应 |
FeO+2H+=
Fe2++H2O
|
Fe2O3+6H+=
2Fe3++3H2O |
Fe3O4+8H+=
Fe2++2Fe3++4H2O |
与CO的反应 |
FexOy+yCO xFe+yCO2 xFe+yCO2 |
②铁的氢氧化物
氢氧化物 |
氢氧化亚铁 |
氢氧化铁 |
化学式 |
Fe(OH)2 |
Fe(OH)3 |
化学性质 |
Fe(OH)2+2H+=Fe2++2H2O
4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
Fe(OH)3+3H+=Fe3++3H2O
2Fe(OH)3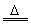 Fe2O3+3H2O Fe2O3+3H2O |
制法 |
可溶性碱与亚铁盐溶液反应
Fe2++2OH-=Fe(OH)2↓ |
可溶性碱与铁盐溶液反应
Fe3++3OH-=Fe(OH)3↓ |
(4)Fe2+和Fe3+的性质
a.Fe3+的鉴别:
鉴别Fe3+的试剂:KSCN溶液
鉴别离子方程式:Fe3++3SCN-=Fe(SCN)3(红色)
b.Fe2+和Fe3+性质对比
| |
Fe2+ |
Fe3+ |
溶液颜色 |
淡绿色 |
棕黄色 |
加碱溶液 |
白色沉淀迅速变成灰绿色最后变成红褐色 |
红褐色沉淀 |
加KSCN溶液 |
无明显现象 |
溶液变红色 |
c.Fe2+既有氧化性又有还原性,以还原性为主
4Fe2++O2+4H+=4Fe3++2H2O (Fe2+被氧化)
2Fe2++H2O2+2H+=2Fe3++2H2O
d.Fe3+具有较强的氧化性,与S2-、I-、 等能发生氧化还原反应
等能发生氧化还原反应
2Fe3++S2-=2Fe2++S↓
2Fe3++2I-=2Fe2++I2
e.Fe3+是典型的弱碱阳离子,与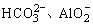 等在溶液中发生双水解反应
等在溶液中发生双水解反应
2Fe3++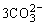 +3H2O=2Fe(OH)3↓+3CO2↑
+3H2O=2Fe(OH)3↓+3CO2↑
f.Fe3+遇苯酚溶液呈紫色,可用于检验Fe3+:
Fe3++6C6H5OH→[Fe(C6H5O)6]3-+6H+
(紫色)
g.亚铁盐、铁盐的实验室保存方法:亚铁盐溶液——隔绝空气加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液以防止Fe2+水解。铁盐溶液——加入少量相应的酸溶液以防止Fe3+水解。
0 +2 +3
(5)铁三角(Fe、Fe、Fe)的转化关系
①Fe只有还原性,可以被氧化成Fe2+和Fe3+,Fe3+只有氧化性,可被还原成Fe2+,Fe2+既有氧化性又有还原性,遇到较强氧化剂时可被氧化成Fe3+,遇较强还原剂时被还原为单质Fe。
练3、对FeSO4溶液进行如下实验,指出实验现象,写出有关反应的离子方程式或化学方程式。
⑴滴入氯水
2Fe2++Cl2=2Fe3++2Cl-;溶液变黄色
⑵长久露置在空气中
4Fe2++4H++O2=4Fe3++2H2O;变黄
⑶滴入稀HNO3
3Fe2++4H++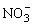 =3Fe3++NO↑+2H2O;溶液变黄
=3Fe3++NO↑+2H2O;溶液变黄
⑷滴入3%H2O2溶液
2Fe2++H2O2+2H+=2Fe3++2H2O;变黄
⑸滴入酸性KMnO4溶液
5Fe2++8H++ =5Fe3++Mn2++4H2O;紫色消失
=5Fe3++Mn2++4H2O;紫色消失
练4、对FeCl3溶液进行如下实验,指出实验现象,写出有关反应的离子方程式。
⑴加Cu粉振荡
2Fe3++Cu=2Fe2++Cu2+;溶液颜色变浅
⑵加还原Fe粉振荡
2Fe3++Fe=3Fe2+;溶液颜色变浅
⑶滴入KI溶液后再加CCl4振荡静置
2Fe3++2I-=2Fe2++I2;溶液分层;上层无色下层紫色
⑷滴加Na2S溶液
2Fe3++S2-=2Fe2++S↓;溶液变浑浊
⑸通入H2S
2Fe3++H2S=2Fe2++S↓+2H+;溶液变浑浊
⑹通入SO2
2Fe3++SO2+2H2O=2Fe2++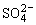 +4H+;溶液颜色变浅
+4H+;溶液颜色变浅
②Fe2+、Fe3+转化成单质铁一般是高温时利用还原剂(H2、C、CO、Al)进行还原生成。
(6)铁的冶炼
练5、硫铁矿在高温下被空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3。设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为________L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为_______L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2的氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a与b的关系式。
②在下图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)
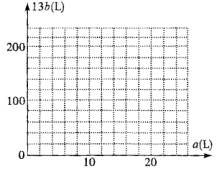
说明:为方便作图,纵坐标用13b表示
解:
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
4 mol 11mol
1 mol 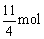
v(O2)=  ×22.4L·mol-1÷0.2=308 L
×22.4L·mol-1÷0.2=308 L
(2)4FeS2 + 11O2 = 8SO2 + 2Fe2O3 △v
11 8 11-8=3 L
55L×0.2x
11︰55×0.2=3︰xx=3 L
△v=55 L-3 L=52 L
(3)设SO2体积分数为y,则
4FeS2+11O2=2Fe2O3+8SO2
11 8
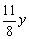 y
y
由N2在反应前后体积守恒:
4(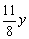 +0.0800)=1-0.0800-y
+0.0800)=1-0.0800-y
y=0.0923
(4) 4FeS2+11O2=2Fe2O3+8SO2
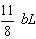 b L
b L
根据反应前后N2体积不变,有
100-a-b=(a+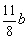 )×4
)×4
化简:13b=200-10a
①若FeS2未完全反应,则100L混和气体中v(O2)=a=20L v(SO2)=b=0
②若FeS2完全反应,设反应了O2 11m L,则
4FeS2+11O2=2Fe2O3+8SO2
11m 8m
有11m×20%+11m×1.2×4+8m=100
其中11m×20%为剩余O2;11m×1.2×4为没有参加反应的N2的总量,8m为生成余SO2,解之得m= ,故a=11m×20%=3.5,13b=200-10a=165
,故a=11m×20%=3.5,13b=200-10a=165
由①得坐标(20,0),由②得坐标(3.5,165),作图如下:

注:斜线的端点坐标为a=3.5,13b=165
3、金属的冶炼
(1)冶炼原理
金属元素在自然界中以化合态形式存在,所以转化成零价单质只能是含金属元素的化合物得电子被还原: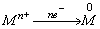 。
。
根据Mn+氧化性强弱的差异,来确定金属的冶炼方法。
(2)金属的冶炼方法
金属的活动性决定该元素在自然界的存在形式。一般活泼的金属在自然界中以化合态存在,而活动性很差的金属则以游离态存在于自然界中,如金以单质形式存在,采用物理方法富集冶炼。在以化合态存在的金属元素中,因活动性不同,采用的方法也不同。
①热分解法:某些不活泼金属的化合物在受热时即可分解生成金属单质。
2HgO 2Hg+O2↑ 2Ag2O
2Hg+O2↑ 2Ag2O 4Ag+O2↑ HgS+O2
4Ag+O2↑ HgS+O2 Hg+SO2
Hg+SO2
②热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适合于金属活动性介于Zn~Cu之间的金属的冶炼。
a.碳还原法因碳资源丰富且价廉,故Sn、Pb、Zn、Fe常用此法冶炼:
SnO2+2C Sn+2CO↑ZnCO3
Sn+2CO↑ZnCO3 ZnO+CO2↑ZnO+C
ZnO+CO2↑ZnO+C Zn+CO↑
Zn+CO↑
b.用H2作还原剂,其特点是得到的金属较纯。
WO3+3H2 W+3H2O (H2作还原剂,适用于冶炼高纯度金属)
W+3H2O (H2作还原剂,适用于冶炼高纯度金属)
c.用Al作还原剂。
Cr2O3+2Al 2Cr+Al2O3 (Al作还原剂,适用于冶炼难熔金属)
2Cr+Al2O3 (Al作还原剂,适用于冶炼难熔金属)
电解法:是最强有力的氧化还原手段,适合于冶炼用普通还原剂难以还原的金属(活动性在Al以前的金属)。
2Al2O3 4Al+3O2↑ 2NaCl
4Al+3O2↑ 2NaCl 2Na+Cl2↑
2Na+Cl2↑
(3)金属的回收和资源保护
a.废旧金属的最好处理方法是回收利用。
b.回收利用废旧金属的意义是减少垃圾量,防止污染环境且缓解资源短缺的矛盾。
例1、0.1 mol镁粉分别在足量的O2、CO2、N2中燃烧,生成固体的质量依次为W1、W2、W3。下列关系式正确的是( )
A.W2>W1>W3 B.W1=W2>W3
C.W1=W2=W3 D.W3>W2>W1
解析:
由2Mg+O2 2MgO知0.1 mol Mg燃烧后增重1.6 g;
2MgO知0.1 mol Mg燃烧后增重1.6 g;
由2Mg+CO2 2MgO+C知0.1 mol Mg燃烧后增重2.2 g:
2MgO+C知0.1 mol Mg燃烧后增重2.2 g:
由3Mg+N2 Mg3N2知0.1 mol Mg在N2中燃烧增重0.93 g。故A选项正确。
Mg3N2知0.1 mol Mg在N2中燃烧增重0.93 g。故A选项正确。
答案:A
例2、甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲︰乙=1︰2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g
C.2.7 g D.1.6 g
解析:
若Al粉对酸、碱均过量,求甲∶乙=?
2Al+6HCl=2AlCl3+3H2↑
6mol 3mol
0.1L×3mol·L-1=0.3mol0.15mol
2Al+2NaOH+2H2O= 2NaAlO2+3H2↑
2mol 3mol
0.3mol 0.45mol
甲︰乙=0.15mol︰0.45mol=1︰3,而题给甲︰乙=1︰2,说明Al粉对HCl过量,对碱不足。应以HCl为计算标准,知Al和HCl反应放出0.15mol H2,由甲︰乙=1︰2可确定Al与NaOH溶液反应放出0.30molH2,进而由:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 3mol
5.4g 0.30mol
答案:A
例3、在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+,Cu2+和Fe2+的物质的量之比为3︰2︰1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1︰2︰4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为( )
A.2︰1 B.1︰2
C.1︰3 D.1︰4
解析:
由n(Fe3+)︰n(Cu2+)︰n(Fe2+)=3︰2︰1,
到:n(Fe3+)︰n(Cu2+)︰n(Fe2+)=1︰2︰4知Cu2+没有参加反应。
设反应前Fe3+、Cu2+、Fe2+物质的量分别为3x,2x,x,由于Cu2+没有参加反应,故仍为2x,据此可知反应后Fe3+、Fe2+物质的量分别为x和4x,则:
2Fe3++Fe=3Fe2+
2x x 3x
(减少)
则原溶液中n(Fe3+)=3x-2x=x
n(Fe2+)=3x+x=4x
参加反应n(Fe)=x,原溶液中n(Fe3+)=3x,
∴n(Fe) ︰n(Fe3+)=x︰3x=1︰3。
答案:C
例4、将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
A.1︰3 B.2︰3
C.1︰4 D.2︰7
解析:
①若AlCl3过量,NaOH不足,“溶液中所含铝元素”应为Al3+。
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
1 mol 3 mol 1 mol
依题意,溶液中剩余l mol Al3+,
则c(AlCl3) ︰c(NaOH)=(1mol+l mol) ︰3 mol=2︰3。
②若NaOH过量,AlCl3完全反应,“溶液中所含铝元素”的存在形式为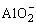 ,设NaOH溶液物质的量浓度为c1,原AlCl3溶液物质的量浓度为c2,体积均为V。
,设NaOH溶液物质的量浓度为c1,原AlCl3溶液物质的量浓度为c2,体积均为V。
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
c1V 3c1V c1V
Al(OH)3+NaOH=NaAlO2+ 2H2O
c2V-3c1Vc2V-3c1Vc2V-3c1V
依题意得c1V-(c2V-3c1V)=c2V-3c1V,这里c1V-(c2V-3c1V)是Al(OH)3的物质的量;c2V-3c1V是溶液中NaAlO2物质的量。
解得c1︰c2=2︰7。
答案:BD
例5、铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:_____________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应___________________________
负极反应___________________________
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1。请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤_______________。
| |
氢氧化物开始
沉淀时的pH |
氢氧化物沉淀
完全时的pH |
Fe3+
Fe2+
Cu2+ |
1.9
7.0
4.7 |
3.2
9.0
6.7 |
提供的药品:Cl2浓H2SO4NaOH溶液CuOCu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式:___________________________________;
劣质不锈钢腐蚀的实验现象:_______________________________。
解析:
把Cu与FeCl3溶液反应设计为原电池,Cu作负极、惰性电极石墨作正极,FeCl3溶液为电解质溶液。除去含Cu2+的溶液中的Fe3+、Fe2+,先把Fe2+氧化为Fe3+,由表中条件可加CuO调节pH为3.2~4.7,使Fe3+转化为Fe(OH)3沉淀而除去。由不锈钢在酸中不易被腐蚀,在某些盐中易被腐蚀,取少量CuO,加入适量H2SO4制成CuSO4溶液,取不锈钢放入CuSO4溶液,若不锈钢表面有红色物质出现,证明易被盐溶液腐蚀。
答案:
(1)2Fe3++Cu=2Fe2++Cu2+
(2)装置图
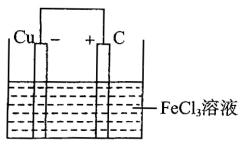
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu
不锈钢表面有紫红色物质生成
例6、标准状况下,取甲、乙、丙各30.0 mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉未,得到下表中有关数据(假设反应前后溶液体积不发生变化)。
实验序号 |
甲 |
乙 |
丙 |
合金质量/mg |
255 |
385 |
459 |
气体体积/mL |
280 |
336 |
336 |
请回答:
(1)甲组实验中,盐酸_________;乙组实验中盐酸_________。(选填“过量”“适量”或“不足量”)
(2)盐酸的物质的量浓度为_________。
(3)合金中Mg、Al的物质的量之比为_________。
(4)丙实验之后,向容器中加入一定量1.00 mol·L-1NaOH溶液,能使合金中的铝粉恰好完全溶解,再过滤出不溶性固体,求所得溶液中各溶质的物质的量浓度。(要求写出计算过程)
解析:
(1)①若比例:255 mg︰280 mL=385 mg︰x成立,则x=423 mL,而现为336 mL,说明乙组合金过量酸不足。
②若比例336︰0.03x=280︰y成立,则y=0.025x,则说明甲组HCl过量。
(2)由乙组酸耗尽求c(HCl)
2HCl ~ H2
2mol 22.4 L
0.03x 0.336 L
2︰0.03x=22.4︰0.336
x=1mol·L-1 c(HCl)=1 mol·L-1
(3)甲组酸过量,Mg、Al耗尽,所以选择甲组数据作为计算根据
设合金中含Al x mol Mg y mol,则:

解之得x=y=0.005 mol x︰y=1︰1
(4)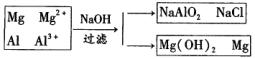
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=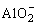 +2H2O
+2H2O
加入一定量NaOH溶液能使合金中的Al粉恰好完全溶解,说明溶液中Al3+最后转化为 ,据此可知溶液中溶质为NaCl和NaAlO2
,据此可知溶液中溶质为NaCl和NaAlO2
由合金中n(Mg) ︰n(Al)=1︰1可设丙中Mg、Al各为z mol,则:24z+27z=0.459 gz=0.009 mol
根据Cl-守恒有:
n(NaCl)=n(HCl)=1mol·L-1×0.03 L=0.03 mol
根据Al元素守恒:n(NaAlO2)=n(Al)=0.009 mol
根据Na元素守恒有n(NaOH)=n(NaCl)+n(NaAlO2)=0.03 mol+0.009mol=0.039 mol
V(NaOH)=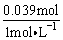 =0.039L
=0.039L
V(总)=0.03L+0.039L=0.069L
c(NaAlO2)=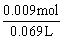 =0.13mol·L-1
=0.13mol·L-1
c(NaCl)=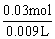 =0.435mol·L-1
=0.435mol·L-1
答案:
(1)过量 不足
(2)1 mol·L-1
(3)1︰l
(4)c(NaAlO2)= 0.13mol·L-1 c(NaCl)= 0.435mol·L-1
例7、现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x。研成粉末后,全部投入含b mol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)用微粒符号填写下列空白(列举出全部可能的情况)。
| |
① |
② |
③ |
④ |
⑤ |
⑥ |
残留固体成分 |
|
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示)______________。
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况下共产生672 mL气体。求a、b的值。
解析:
(1)
Fe粉Cu粉投入稀HNO3后Fe先溶解先发生如下反应:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
然后Cu粉溶解:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
因HNO3过量故Fe(NO3)2被氧化成Fe(NO3)3故可写成:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O知
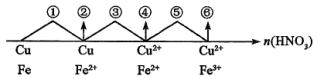
因此有:
| |
残留固体成分 |
溶液中的金属离子 |
① |
Fe、Cu |
Fe2+ |
② |
Cu |
Fe2+ |
③ |
Cu |
Fe2+、Cu2+ |
④ |
— |
Fe2+、Cu2+ |
⑤ |
— |
Fe3+、Fe2+、Cu2+ |
⑥ |
— |
Fe3+、Cu2+ |
(2)当溶液中有Cu2+、Fe2+残留固体为Cu时,b有极小值;
当溶液中有Cu2+、Fe2+而无残留物时,b有极大值
3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O
3mol 8 mol
ax 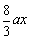
3Fe + 8HNO3 = 3Fe(NO3)2 + 2NO↑ + 4H2O
3 8
a(1-x) 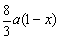
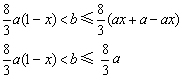
(3)依题意n(Fe)=n(Cu)=0.5a,Fe3+存在,即Cu亦转化为Cu2+,故据得失电子守恒:
