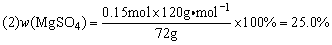1、复习要点阐述
本专题知识内在知识联系


2、要点复习的策略及技巧
Ⅰ、离子反应:有离子参加或离子生成的反应统称为离子反应,高考主要考查电解质在水溶液中发生的反应。主要类型:
(1)在水溶液中进行的复分解反应,如:

CaCO3+2H+=Ca2++H2O+CO2↑(生成气体)
H++OH-=H2O(生成难电离的物质如H2O)
(2)在溶液中进行的氧化还原反应,如:
Zn+2H+=Zn2++H2↑
2Fe2++Cl2=2Fe3++2Cl-
SO2+Cl2+2H2O=4H++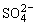 +2Cl-
+2Cl-
Ⅱ、离子方程式:用实际参加反应的离子符号表示的化学反应的式子叫离子反应方程式。
离子方程式不仅表示特定物质间的某个反应,而且还表示所有同一类型的反应,它具有广泛性和本质性。如Ag++Cl-=AgCl↓,不仅表示AgNO3与NaCl之间的反应,而且表示了可溶性银盐与所有可溶性氯化物反应生成氯化银沉淀的反应。
Ⅲ、离子方程式的书写规则
(1)强酸、强碱和易溶于水的盐在离子反应方程式中写离子符号,难溶物质、难电离物质、气体、单质、非电解质等均写化学式。
(2)微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。微溶物作为生成物,一般写化学式(标↓号)。
(3)氨水作为反应物写NH3·H2O;作为生成物,若有加热条件或浓度很大时,可写NH3(标↑号)。
(4)固体与固体间的反应不能写离子方程式,浓H2SO4、浓H3PO4与固体物质的反应一般不能写离子方程式。
(5)离子方程式遵循电荷守恒、质量守恒。
(6)一些特殊的反应[如有酸式盐参加或生成的反应,两种或两种以上的离子被一种物质氧化或还原,Ba(OH)2与KAl(SO4)2按不同量的反应等]要考虑并满足反应物之间物质的量的比值。
(7)多元弱酸酸式酸根离子
属弱电解质
,在离子方程式中不能写离子符号。
Ⅳ、离子在溶液中相互反应的规律
离子反应发生的条件,也就是离子不能大量共存的原因。
(1)相互结合生成难溶或微溶物质的离子不能大量共存,如:Fe2+与S2-,Ca2+与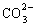 ,Ag+与I-,Ca2+与
,Ag+与I-,Ca2+与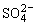 等不能在溶液中大量共存。
等不能在溶液中大量共存。
(2)相互结合生成气体物质的离子不能大量共存,如:S2-与H+,H+与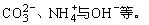
(3)相互结合生成难电离物质的离子不能大量共存,如:H+与OH-,H+与ClO-,Fe3+与SCN-等。
(4)发生氧化还原反应的离子不能大量共存,如:Fe3+与S2-,Fe3+与I-;在酸性溶液中, 与Fe2+,ClO-与S2-不能共存。
与Fe2+,ClO-与S2-不能共存。
(5)发生双水解反应的离子不能大量共存,如Al3+、Fe3+分别与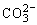 、HCO-、AlO2-、Al3+与S2-等。
、HCO-、AlO2-、Al3+与S2-等。
(6)弱酸酸式酸根离子不能与H+、OH-共存,如:HCO3-与H+,HCO3-与OH-,H2PO4-与H+,H2PO4-与OH-等。
(7)若题目中提示酸性溶液(pH<7)或碱性溶液(pH>7)应在各待选答案中均加入H+或OH-考虑。
(8)若题目中告知是无色溶液,应在各待选答案中排除具有颜色的Fe3+、Cu2+、Fe2+、MnO4-等离子。
Ⅴ、分散系
本部分内容是历年高考的热点,题型包括选择题、问答题、填空题和计算题,特别是涉及相关概念的辨析与应用的题目出现频率较高。本部分内容的有关知识,《考试大纲》中有以下几项基本要求:
①了解溶液的含义。②了解溶液的组成,理解溶液中溶质的质量分数的概念。③了解饱和溶液、不饱和溶液的概念,了解溶解度的概念,了解温度对溶解度的影响及溶解度曲线。④初步了解结晶、结晶水、结晶水合物、风化、潮解的概念。⑤了解胶体的概念及其重要性质和应用。
1、常见分散系
(1)分散系:由一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物。分散系中分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(2)常见分散系的比较
| |
溶液 |
胶体 |
悬、乳浊液 |
分散质粒子大小/m |
<10-9 |
10-9~10-7 |
>10-7 |
外观特征 |
均匀、透明、稳定 |
均匀、透明、较稳定 |
不均匀、不透明、不稳定 |
能否通过滤纸 |
√ |
√ |
× |
能否通过半透膜 |
√ |
× |
× |
实例 |
NaCl、蔗糖溶液 |
Fe(OH)3胶体 |
泥水、牛奶 |
2、胶体特征及性质
(1)胶体的本质特征:分散质粒子直径在10-9~10-7m之间。
(2)胶体的性质
①丁达尔现象
a.形成原理:(与分散质粒子的大小有关)

b.应用:区别溶液与胶体。溶液无丁达尔效应,胶体有丁达尔效应。
②布朗运动
形成原理:每一瞬间胶体粒子在不同方向受分散剂分子撞击的力是不相同的,因而形成不停的、无秩序的运动。
③电泳
a.电泳:在外加电场作用下,胶体粒子在分散剂里向电极(阴极或阳极)作定向移动的现象。
b.结论:胶体粒子带有电荷(表面积较大,能吸附离子)。
④胶体的凝聚
胶体较稳定的主要因素是一种胶体中的胶粒因吸附相同离子而带同种电荷。一般而言,金属氢氧化物、金属氧化物的胶粒带正电;非金属氧化物、金属硫化物胶粒带负电。
胶体凝聚的方法有:加电解质溶液;加入带相反电荷的另一种胶体;加热等。
3、胶体的制备和提纯
①Fe(OH)3胶体:将1~2mL FeCl3饱和溶液滴入20mL沸水中至显红褐色。
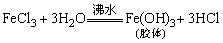
②AgI胶体:将0.01mol·L-1 AgNO3溶液8~10滴逐滴加入10mL 0.0lmol·L-1 KI溶液中,边滴加边振荡。
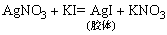
③硅酸胶体:将1mL水玻璃滴加到5~10mL 1mol·L-1盐酸中,边滴加边振荡。

④提纯:用渗析法,利用胶粒不能透过半透膜的性质将胶体进行提纯。
考点1:对胶体知识的考查
下列现象或应用不能用胶体知识解释的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.向牛油和氢氧化钠溶液共煮后的溶液中加入食盐后有固体析出
C.水泥、冶金工厂常用高压电除去烟尘,减少对空气的污染
D.氯化铝溶液中加人碳酸钠溶液会出现白色沉淀
解题思路:
选项A中血液是一种胶体因此血液透析原理和胶体渗析原理相同;选项B中牛油和氢氧化钠溶液共煮后得到高级脂肪酸钠,该分散系属于胶体,加食盐后高级脂肪酸钠析出而得以分离;选项C中利用电泳原理除尘;选项D中因为发生双水解反应而产生沉淀。
答案:D
技巧归纳:在外电场作用下,胶粒就会在分散剂里向阴阳两极做定向移动,这种现象叫做电泳。原因:胶粒带有电荷(胶粒的表面积很大,吸附能力很强,能选择性地吸附溶液中的离子而带有电荷)。注意:①胶体微粒带有电荷,但整个分散系仍是电中性的。②固溶胶不能发生电泳现象。③胶体微粒带有电荷是胶体稳定的主要原因。
考点2:对溶解度基础知识的考查
甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是( )
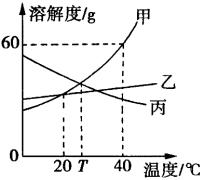
A.40℃时,100g水中最多溶解甲60g
B.T℃时,甲与丙的溶解度相等
C.分别将40℃时甲、丙的饱和溶液降温至T℃,所得两溶液中溶质的质量分数相等
D.乙中混有少量甲,可用降温结晶法提纯甲
解题思路:
选项C中分别将40℃时甲、丙的饱和溶液降温至T℃,丙变为不饱和溶液,质量分数和原溶液相同,甲溶液中会析出晶体,质量分数变小,因此溶质的质量分数甲小于丙。当乙中混有少量甲时,应用蒸发溶剂法来提纯乙,相反,当甲申混有少量乙时,可采用冷却热饱和溶液法即降温结晶法提纯甲。
答案:CD
技巧点拨:温度作横坐标,溶解度作纵坐标,画出的溶解度随温度变化的曲线称为溶解度曲线。要了解:①曲线图所画的任何曲线上表示的溶质质量;都是指100g水中所溶解的最大量,若溶剂为其他任意值,应按比例关系推算,也同样可以依此算出饱和溶液的溶质质量分数;②从溶质溶解度曲线的走势可判断出该物质溶解性随温度升降的增减趋向;③多条溶解度曲线在图中的交汇点,表示在该点对应温度下,溶解度恰好相等。
考点3:浓度的计算与换算
下列说法正确的是( )
A.把100mL 3mol·L-1的H2SO4跟100mL H2O混合后,硫酸的物质的量浓度变为1.5mol·L-1
B.把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10%
C.把200mL 3mol·L-1的BaCl2溶液跟100mL 3mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol·L-1
D.把100mL 20%的NaOH溶液跟100mL H2O混合后,NaOH溶液的质量分数是10%
解题思路:
硫酸和水混合后体积小于200mL,因此硫酸的物质的量浓度大于1.5mol·L-1,A错;B中混合前后溶液的总质量不变,因此质量分数是原来的一半即10%;BaCl2溶液中Cl-浓度为6mol/L,因此两者混合后Cl-浓度介于3mol/L~6mol/L之间,C错;NaOH溶液的密度大于水的密度,两者等体积混合时,NaOH溶液的质量大于水的质量,混合后所得NaOH溶液的质量分数大于10%,D错。答案:B
要点探究:溶液的稀释与混合规律:(1)溶液稀释前后,溶质的质量(或物质的量)不变。溶液的质量等于稀释前溶液质量和所加入水的质量之和;溶液的体积需用稀释后溶液质量除以其密度求算。若溶液较稀时;则可近似认为是两体积之和。(2)含相同溶质溶液的混合,混合后溶质的质量(或物质的量)、溶液体积的求算等同于溶液的稀释。(3)含不同溶质溶液的混合,若溶质间不发生化学反应,各溶质的质量遵循溶液的稀释规律。(4)含不同溶质溶液的混合,若溶质间发生化学反应时,混合后溶质的种类、溶质的质量(或物质的量)、溶液的体积都会发生变化。(5)要获得某浓度的某种溶液,可有多种途径,如若得到20%的NaOH溶液:①Na与水反应;②NaOH溶解;③Na2O或Na2O2溶于适量水中;④浓的NaOH溶液稀释;⑤适当浓度的Na2CO3溶液加适量Ca(OH)2或CaO等。
技巧点拨:溶液浓度的计算与换算过程中要牢牢抓住概念进行求解。
(1)溶液稀释定律
①对于已知质量分数溶液的稀释:溶质的质量稀释前后不变,即m1·w1=m2·w2。
②对于已知物质的量浓度溶液的稀释:溶质的物质的量稀释前后不变,即c1V1=c2V2。
(2)物质的量浓度与溶质质量分数的换算

(3)标准状况下求气体溶解干水后所得溶液的物质的量浓度的计算
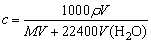 ,式中V为标准状况下气体体积,V(H2O)为水的体积,ρ为溶液的密度。
,式中V为标准状况下气体体积,V(H2O)为水的体积,ρ为溶液的密度。
近几年来对离子方程式的书写从定性考查发展到定量考查,涉及到“量”的离子方程式的书写往往是复习中的一大难点,现予以系统介绍:
(一)试剂滴加顺序涉及到的“量”
例1、写出下列实验操作过程中所发生反应的离子方程式,并指出实验现象
(1)向盛有AlCl3溶液的试管中滴加2~3滴NaOH溶液并振荡试管
(2)向盛有NaOH溶液的试管中滴加2~3滴AlCl3溶液并振荡试管
(3)向盛有NaOH溶液的试管中滴加AlCl3溶液,边滴边振荡直至过量
解析:
反应物的用量和滴加试剂次序与生成物有关,一般说来开始滴加时,滴加的物质是少量的,接受滴加的物质是过量的。
答案:
(1)生成白色絮状沉淀
Al3++3OH-=Al(OH)3↓
(2)先生成白色絮状沉淀后沉淀溶解
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
(3)先生成白色絮状沉淀,后沉淀溶解,溶液变澄清,澄清溶液又变浑浊。
A13++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
Al3++3AlO2-+6H2O=4Al(OH)3↓
点评:离子反应与试剂滴加顺序有关,其实质是与反应物用量有关。
(二)酸式盐与碱的反应涉及到的“量”
中和反应有狭义的中和反应和广义的中和反应之分。例如酸和碱的反应便属于狭义的中和反应,而更多的一类反应,则是广义的中和反应,例如酸式盐和碱的反应。因此我们有理由给酸、碱重新下定义:凡是放出质子的是酸,凡是接受质子的是碱。这样有利于我们讨论和研究问题。
例2、按下列体积比混合写出相同物质的量浓度的NaH2PO4溶液和Ba(OH)2溶液混合的离子反应方程式。
(1)V(NaH2PO4)︰V[Ba(OH)2]=1︰1
(2)V(NaH2PO4)︰V(Ba(OH)2)=2︰3
解析:
先按体积比写出NaH2PO4和Ba(OH)2反应化学方程式:
(1)3NaH2PO4+3Ba(OH)2=Ba3(PO4)2↓+Na3PO4+6H2O
(2)2NaH2PO4+3Ba(OH)2=Ba3(PO4)2↓+4H2O+2NaOH
然后再改写成离子方程式就较容易了,这是一种化繁为简的方法。
答案:
由题给条件将两者体积比换算为物质的量之比为:
(1)n(NaH2PO4)︰n[Ba(OH)2]=1︰1时,两者恰好发生中和反应,故离子方程式为:
3H2PO4-+3Ba2++6OH-=Ba3(PO4)2↓+PO43-+6H2O
(2)当n(NaH2PO4)2︰n[Ba(OH)2]=2︰3时,碱过量,中和反应离子方程式为:
2H2PO4-+3Ba2++4OH-=Ba3(PO4)2↓+4H2O
点评:在酸碱发生中和反应时,若酸过量对于多元酸而言则生成酸式盐,碱过量则生成正盐。
例3、写出下列反应的离子方程式
(1)碳酸氢钙溶液中加入等物质的量的NaOH溶液
(2)碳酸钠溶液中加入等物质的量的乙酸。
解析:
按要求写出发生化学反应方程式:
(1)Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2O
(2)Na2CO3+CH3COOH→NaHCO3+CH3COONa
答案:
(1)Ca2++HCO3-+OH-=CaCO3↓+H2O
(2)CO32-+CH3COOH→HCO3-+CH3COO-
点评: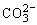 和H+反应放出CO2是分步进行
和H+反应放出CO2是分步进行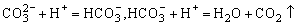 ,本题(2)小题易出现:
,本题(2)小题易出现: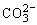 +2CH3COOH→2CH3COO-+CO2↑+H2O的错误,出现此错误的原因是:反应时,没有考虑“量”的关系。
+2CH3COOH→2CH3COO-+CO2↑+H2O的错误,出现此错误的原因是:反应时,没有考虑“量”的关系。
(三)溶液中氧化还原反应涉及到的“量”
在溶液中氧化性的离子如:Fe3+、MnO4-、Cu2+、H+等和还原性的离子如:S2-、I-、Fe2+、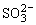 等发生氧化—还原反应往往与“量”有关。
等发生氧化—还原反应往往与“量”有关。
例4、指出下列实验现象并写出反应的离子方程式
(1)向盛有FeCl3溶液的试管中滴入1~2滴Na2S溶液。
(2)向盛有Na2S溶液的试管中滴入1~2滴FeCl3溶液。
解析:
Fe3+是较强氧化剂,S2-是强还原剂,因此在溶液中发生氧化还原反应,但由于量的不同还可能发生复分解反应。
答案:
(1)溶液变浑浊:
2Fe3++S2-=2Fe2++S↓
(2)溶液先变浑浊,随即出现黑色沉淀。
2Fe3++S2-=2Fe2++S↓; Fe2++S2-=FeS↓
点评:Fe3+既显氧化性又因水解而显酸性,S2-显强还原性又因水解而显碱性,两者混合发生氧化还原反应,还是发生双水解反应,这个问题往往困扰着我们,在这里我们要记住Fe3+和S2-混合发生氧化还原反应。
(四)溶液中离子大量共存判断方法
判断离子在溶液中是否大量共存,也存在一个“量”的问题,这是因为能够发生反应的少量离子是可以共存的。例如H++OH-=H2O,而水中存在极少量H+和OH-。故我们讨论溶液中离子共存是指大量离子而言。
因为离子反应总是向着离子数目减少的方向进行,因此离子能否大量共存的判断标准也是这一标准。离子间哪些反应总是向离子数目减少的方向进行的呢?
(1)生成沉淀,气体,难电离的物质。
(2)能发生双水解的离子。
(3)能发生氧化还原反应的离子。
(4)生成微溶物如Ca2+和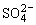 不能大量共存,这是因为在Ca2+、
不能大量共存,这是因为在Ca2+、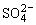 大量存在的情况下:
大量存在的情况下: 。
。
例5、下列各组中的离子能在pH=1的无色溶液中大量共存的是( )
A.K+、Na+、I-、MnO4-
B.Mg2+、Cl-、Al3+、SO42-
C.K+、Cl-、HCO3-、NO3-
D.Ca2+、Na+、Fe3+、Br-
解析:
对于A.因发生氧化还原反应:2MnO4-+10I-+16H+=2Mn2++5I2+8H2O而不能大量共存;
对于C,因发生复分解反应:H++HCO3-=CO2↑+H2O而不能大量共存;
对于D,Fe3+溶液呈黄色。
答案:B
点评:解答离子共存题,要看清题目,审清题意,挖掘隐蔽条件。有的离子虽不存在于题目中的离子组中,但有时在条件中“隐蔽”出现,如某强酸性(或强碱性)溶液中能大量共存,说明溶液中除离子组内各离子外,还应有H+(或OH-)。此外,还要注意溶液是否有颜色。如Cu2+、Fe3+、MnO4-等都有颜色,若为无色则说明其不存在。
(五)怎样解有关“分散系”的综合题
例6、有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是__________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是___________________。
此液体具有的性质是__________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为__________。
②原无色有刺激性气味的气体与含1.5mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是______________________________。
解题思路:
(1)由ZY3遇苯酚溶液呈紫色可知ZY3为FeCl3即Y为氯元素,由X2-、Y-与HCl具有相同的电子数(18个)可知X为硫元素。(2)FeCl3滴入沸水中生成Fe(OH)3胶体,能发生丁达尔现象、电泳等。(3)①S在空气中燃烧生成SO2,与O2进一步氧化:2SO2+O2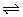 2SO3
2SO3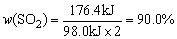 。②由该酸的某盐常用于实验室制O2可推出Y的含氧酸为HClO3由1.5mol HClO3反应转移1.5mol e-知Cl元素化合价降低及还原产物为ClO2;S被氧化成+6价。
。②由该酸的某盐常用于实验室制O2可推出Y的含氧酸为HClO3由1.5mol HClO3反应转移1.5mol e-知Cl元素化合价降低及还原产物为ClO2;S被氧化成+6价。
答案:
(1)HClO4
(2)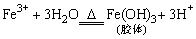 a、b、d
a、b、d
(3)①90% ②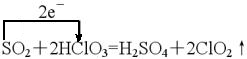
技巧归纳:熟记某些物质的特殊颜色或某些物质的特殊反应是寻找解题突破口的关键。例如FeCl3遇苯酚溶液显紫色即为解答本题的突破口。
例7、将过量Mg粉溶于100mL 1.5mol·L-1稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下蒸发,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,当析出晶体12.3g时,剩下滤液48.0g。通过计算请回答下列问题(请写出计算过程)。
(1)生成标准状况下的气体体积;
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
解析:
n(H2SO4)=0.1L×1.5mol·L-1=0.15mol
(1)Mg + H2SO4 = MgSO4 + H2↑
0.15mol 0.15mol 0.15mol
V(H2)=22.4L·mol-1×0.15mol=3.36L