(一)复习要点阐述
1、非金属元素在周期表中位置:
除氢外,位于周期表右上方不包括稀有气体元素共16种元素,包括稀有气体元素则22种。
2、原子结构特点:
(a)在同周期中原子半径较小,核电荷数较大
(b)最外层电子数大于或等于4个,但例外的是Sb、Bi最外层有5个电子是金属元素。
3、非金属单质物理性质:
(a)分子晶体:熔、沸点较低,硬度小。例如:H2、Cl2、F2、硫磺、白磷等。
(b)原子晶体:熔、沸点较高,硬度大。例如:金刚石、单晶硅等。
4、同素异形体:
(a)分子中因原子个数不同而形成的同素异形体。例如:O2和O3。
(b)因晶体中原子排列方式不同而形成同素异形体。例如:红磷与白磷;金刚石与石墨。
5、常见非金属单质的化学性质:
(1)金属元素易形成简单的阳离子,非金属元素易形成单原子或多原子阴离子。
(2)绝大多数常见的非金属元素能与H2反应:
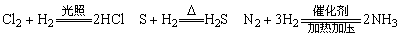
规律:非金属原子半径越小、最外层电子数越多则和氢化合的能力越强。
(3)绝大多数非金属元素能与O2反应:

规律:凡非金属性比氧弱的非金属元素均能与氧化合。
(4)部分非金属元素单质能与强碱液反应:
Cl2+2NaOH=NaCl+NaClO+H2O
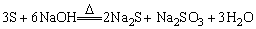
4P+3NaOH+3H2O=3NaH2PO2+PH3↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
2B+2NaOH+2H2O=2NaBO2+3H2↑
特例:碳、氮、氧、氟无上述反应。
(5)大多数非金属不与水反应。但有如下少数反应:
2F2+2H2O=4HF+O2
X2+H2O HX+HXO (X为Cl2、Br2、I2)
HX+HXO (X为Cl2、Br2、I2)
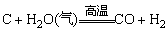
(6)非金属元素一般为成酸元素,其单质难以与稀酸反应。
固体非金属单质能被氧化性酸氧化:

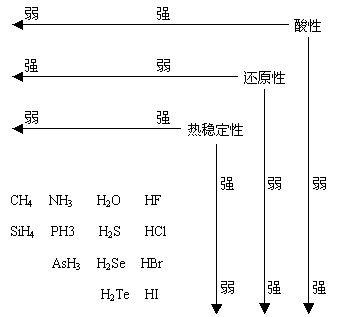
⑦非金属元素气态氢化物有关性质规律
6、非金属单质的制备
(1)在化合物中呈负价态的非金属元素用氧化法制备:
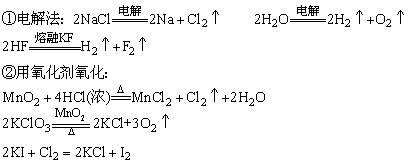
(2)在化合物中呈正价态的非金属元素用还原法制备:

(3)其它方法:
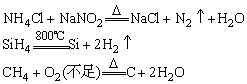
7、重要非金属化合物的制备
物质 |
实验室制法 |
工业制法 |
其他 |
NH3 |
2NH4Cl+Ca(OH)2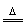 CaCl2+2NH3↑+2H2O CaCl2+2NH3↑+2H2O |
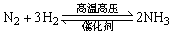
|
只能用碱性干燥剂如碱石灰干燥不能用无水CaCl2干燥 |
NO |
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |

|
制硝酸的尾气NO和NO2用碱液来吸收
NO+NO2+2NaOH=2NaNO2+H2O |
NO2 |
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O |
2NO+O2=2NO2 |
HNO3 |
NaNO3+H2SO4(浓)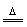 NaHSO4+HNO3↑ NaHSO4+HNO3↑ |
NH3→NO→NO2
3NO2+H2O=2HNO3+NO |
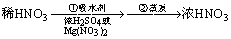
|
H3PO4 |
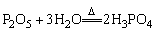
|
Ca3(PO4)2+2H2SO4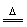 2H3PO4+3CaSO4↓ 2H3PO4+3CaSO4↓ |
|
普钙(过磷酸钙) |
|
Ca3(PO4)2+2H2SO4(浓)=Ca(H2PO4)2+2CaSO4↓ |
磷肥往往和农家肥混合使用但不能与草木灰混用 |
重钙 |
|
Ca3(PO4)2+4H3PO4(浓)=3Ca(H2PO4)2 |
(二)要点复习的策略及技巧
1、氯气
(1)物理性质
通常情况下,氯气呈黄绿色,有毒并有剧烈的刺激性,溶于水,易液化。
(2)化学性质

(3)氯气的实验室制法
①制备原理:用氧化剂将-1价的氯离子氧化成单质氯。
②反应化学方程式:
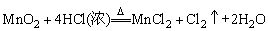
根据上述反应原理,下列反应均可制备Cl2:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(3)实验装置如下图所示:
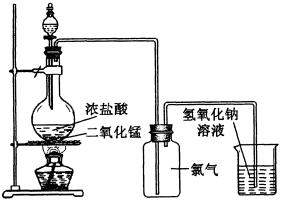
在制备过程中,为使分液漏斗中浓HCl能顺利滴下常使用连通管装置使分液漏斗和圆底烧瓶内压强相等。因而能使浓HCl顺利滴下。
(4)氯气的工业制法
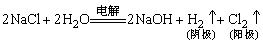
(5)氯水的成分和性质
通常状况下,l体积水可溶解2体积Cl2,形成黄绿色的溶液,称为氯水。溶于水的Cl2部分(约39%)与水反应:Cl2+H2O=HCl+HClO,余者仍以氯分子的形式存在于溶液中。故新制的氯水中主要含有Cl2、HClO、H2O、H+、Cl-、ClO-和极少的OH-。而久置的氯水由于: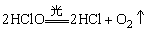 ,而变成很稀的盐酸。我们通常所说的氯水都是指新制的氯水需随配随用,保存在棕色瓶中。
,而变成很稀的盐酸。我们通常所说的氯水都是指新制的氯水需随配随用,保存在棕色瓶中。
氯水是一种混合物,可以表现出多重性质:
①提供Cl2分子,作氧化剂,如氯水与氨气、H2S、Na2SO3、FeSO4、NaI、NaBr、金属单质等还原性物质反应,主要是Cl2作氧化剂。
②提供H+(HCl电离),表现酸性。如氯水中加入CaCO3粉末,有CO2产生。此过程中可增大溶液中HClO的浓度。
③提供Cl-,与Ag+反应。如用自来水配制AgNO3溶液时,会出现浑浊(AgCl)。
④氯水中含HClO,表现强氧化性。如氯水能漂白、杀菌、消毒等。
⑤同时表现多种微粒的性质。如氯水与紫色石蕊试液作用,实验现象:先变红(酸的通性),后褪色(HClO的强氧化性)。
2、卤素元素
练1、卤族元素在结构和性质上有哪些相似性?
(1)卤素原子最外层有7个电子,均能形成-1价阴离子X-(X为F、Cl、Br、I)。
(2)氯、溴、碘三元素最高正价为+7价,此外主要价态还有0,+1,+3,+5价。
(3)卤素单质皆为双原子分子,通式为X2。
(4)卤化氢通式为HX。HX气体在潮湿空气中呈现白雾,均易溶于水除HF外其余氢卤酸皆为强酸。
(5)卤素除氟外其最高价氧化物通式X2O7,X2O7对应的水化物通式为HXO4。
(6)单质与H2反应:H2+X2=2HX
(7)单质与水反应:X2+H2O=HX+HXO (X2为:Cl2、Br2、I2)
(8)单质与碱反应:X2+2KOH=KX+KXO+H2O (X2为Cl2、Br2、I2)
(9)单质与金属反应生成金属卤化物其中AgX(AgF除外)难溶。CaX2(CaF2除外)易溶。
(10)卤素在有机溶剂中的溶解度比其在水中溶解度大得多。
(11)卤素单质的制法: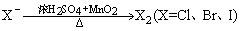

练2、卤素元素在结构和性质上有哪些递变性?

练3、卤素单质有哪些特殊性?
(1)氟无氧化物,只有氧的氟化物:OF2
(2)氟能与惰性气体形成化合物如:XeF2、XeF4、XeF6等。
(3)氟与水反应放出O2:2F2+2H2O=4HF+O2
(4)氢氟酸是弱酸,HF分子间形成氢键使HF在水溶液中形成缔合分子(HF)n难电离出H+,
HFO中氟显-1价,氧元素显0价。
(5)氢氟酸腐蚀玻璃:SiO2+4HF=SiF4↑+2H2O,故氢氟酸要保存在塑料试剂瓶中。
(6)氯气易液化,溴易挥发,碘易升华。碘遇淀粉溶液变蓝。

(8)I2易溶于KI溶液: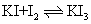
3、碳族元素
(1)碳族元素在周期表中的位置、原子结构和性质
①位于周期表ⅣA族,包括C、Si、Ge、Sn、Pb。
②原子最外层电子数均为4个。
③主要价态:+4、+2价。C、Si、Ge、Sn的+4价化合物是稳定的,而Pb的+2价化合物是稳定的。碳、硅一般以共价键形成种类繁多的化合物。
(2)碳族元素性质递变规律
碳族元素性质递变规律

|
C |
Si |
Ge |
Sn |
Pb |
主要化合价 |
+2、+4 |
+2、+4 |
+2、+4 |
+2、+4 |
+2、+4 |
单质色、态 |
无色或黑色固体 |
灰黑色固体 |
银白色固体 |
银白色固体 |
蓝白色固体 |
气态氢化物
及稳定性 |
CH4 |
SiH4 |
GeH4 |
SnH4 |
PbH4 |
稳定性逐渐减弱 |
主要氧化物 |
CO、CO2 |
SiO2 |
GeO、GeO2 |
SnO、SnO2 |
PbO、PbO2 |
最高价氧化物对应的水化物及酸碱性 |
H2CO3 |
H2SiO3 |
Ge(OH)4 |
Sn(OH)4 |
Pb(OH)4 |
酸性逐渐减弱,碱性逐渐增强 |
金属性、非金属性 |
非金属性减弱,金属性增强 |
(3)单质碳的性质
①碳的同素异形体
碳有多种同素异形体,如金刚石、石墨、C60、C70等,它们在物理性质上存在差异。如金刚石硬度很大,而石墨则质软,石墨可以导电,金刚石则不导电等。
②化学性质

(4)二氧化碳的性质
①物理性质:无色无味,密度比空气大的气体,微溶于水,固体CO2叫做“干冰”。
②化学性质
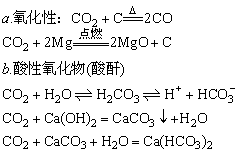
③制法
a.工业制法:煅烧石灰石
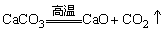
b.实验室制法:石灰石和稀盐酸反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
“固+液→气”型,可用启普发生器及其简易装置。
④用途:灭火剂,制纯碱,汽水;干冰用作制冷剂或人工降雨等。
(5)一氧化碳的性质
①物理性质:元色无味的气体,有毒,不溶于水。
②化学性质

③毒性:CO剧毒,与血液里的血红蛋白结合的能力比O2和血红蛋白结合的能力强350倍故CO中毒的机理是,使人体缺氧而死亡。CO是空气污染物之一,主要来自碳燃料的不完全燃烧及钢铁的冶炼等。
4、硅和二氧化硅
(1)碳和硅化学性质对比
碳 |
硅 |
①高温下表现出强还原性

|
①高温下表现出弱还原性
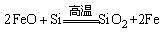 (炼钢) (炼钢)
|
②和O2反应: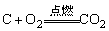 |
②和O2反应:
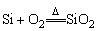
|
③和碱不反应 |
③和碱反应:
Si+2NaOH+H2O=Na2SiO3+2H2↑ |
④和H2O(g)反应:
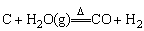
|
④和F2反应
Si+2F2=SiF4↑ |
⑤和浓H2SO4反应:
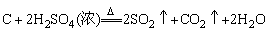
|
⑤和HF反应
Si+4HF=SiF4+2H2↑ |
⑥和某些氧化物反应:

|
⑥和卤素反应
Si+2Cl2=SiCl4 |
(2)二氧化硅的化学性质
①具有弱氧化性:
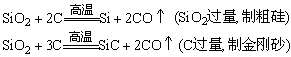
②酸性氧化物,是硅酸的酸酐,具有酸性氧化物的通性:

③与某些盐的反应:
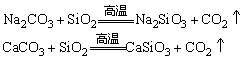
(上述两个反应为工业制玻璃的主要反应)
④特性:SiO2+4HF=SiF4↑+2H2O(氢氟酸腐蚀玻璃)
练4、金刚石与晶体硅有哪些相似性?
金刚石与晶体硅都是一种具有空间网状结构的原子晶体,所以它们的熔点高、硬度大。但是由于硅的原子半径大于碳的原子半径:所以在晶体中,C—C键的键长小于Si—Si键,而键能大于Si—Si键,因此金刚石的熔沸点和硬度比晶体硅高。
练5、为什么二氧化硅和二氧化碳的物理物质有很大差别?
二氧化硅熔点高、硬度大,是不溶于水的固体,而二氧化碳是无色无味的气体,能溶于水,干冰熔点低、硬度小。它们的物理性质差别很大的原因是:SiO2为原子晶体,而干冰为分子晶体,微粒间的作用力前者为共价键,后者为分子间作用力,前者要大得多。
练6、怎样理解硅和NaOH溶液反应放出氢气?
硅与烧碱反应的化学方程式为:
Si+2NaOH+H2O=Na2SiO3+2H2↑
似乎此反应中H2O和NaOH均为氧化剂,但事实并非如此。此反应可看作分两步进行:
①Si+3H2O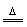 H2SiO3+2H2↑
H2SiO3+2H2↑
②H2SiO3+2NaOH=Na2SiO3+2H2O
两个反应的化学方程式加合即为前式。因此,反应中H2O是氧化剂,而NaOH既不是氧化剂也不是还原剂,仅为反应物。为表示反应实质,上述反应可写成:
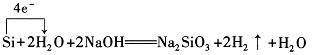
工业上怎样制备高纯硅?
制粗硅
提纯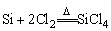 (生成的SiCl4通过精馏,除去其中的硼、砷等杂质)
(生成的SiCl4通过精馏,除去其中的硼、砷等杂质)
还原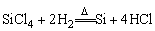 (H2还原SiCl4得到纯度较高的多晶硅,由多晶硅制得高纯度的单晶硅)
(H2还原SiCl4得到纯度较高的多晶硅,由多晶硅制得高纯度的单晶硅)
练8、怎样由SiO2制备硅酸?
SiO2不溶于水,也不与水反应,但它能与NaOH溶液反应生成盐和水:
SiO2+2NaOH=Na2SiO3+H2O
因此SiO2是酸性氧化物。
将SiO2溶于热的烧碱溶液中,再向溶液中加入定量的盐酸或通入过量的CO2,析出胶状沉淀原硅酸(H4SiO4),再将原硅酸在空气中脱水即可。
4、无机非金属材料
练9、硅石、水晶、玛瑙、脉石、硅藻土、硅胶以及人造宝石的主要成份是什么?
答:硅石是天然的SiO2;玛瑙是含杂质的石英晶体;水晶是透明的石英晶体;硅藻土是无定型的SiO2。它是死去的硅藻及其它微小生物遗体经沉积胶结而成的多孔质软松软的固体物质,这种固体具有表面积大吸附能力强的特点,可作为催化剂,吸附剂的载体。实验室制备硅胶方法如下:Na2SiO3+2HCl=2NaCl+H2SiO3↓,将硅酸溶胶制成吸附剂—即得硅胶,在硅胶中加入无水CoCl2可指示硅胶吸水情况: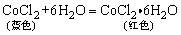 。当硅胶显红色则表明其需要再生。宝石主要成份是:Al2O3,刚玉中若混有少量Cr的化合物因显红色,则称之为红宝石若刚玉中混有Ti的化合物则显蓝色,则称为蓝宝石。
。当硅胶显红色则表明其需要再生。宝石主要成份是:Al2O3,刚玉中若混有少量Cr的化合物因显红色,则称之为红宝石若刚玉中混有Ti的化合物则显蓝色,则称为蓝宝石。
练10、制造普通水泥、普通玻璃、陶瓷的原料各是什么?其主要成份又是什么?
1、水泥:以石灰石、粘土作原料,在高温下发生复杂的物理、化学变化,经熔化、冷却后,再在熟料中加入3%以下的石膏以控制凝结速度,即得普通硅酸盐水泥。
普通水泥的主要成分是硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)和铝酸三钙(3CaO·Al2O3)等。
2、玻璃:以纯碱、石灰石、过量石英为原料,在高温下发生复杂的物理、化学变化,在玻璃窑熔融反应后形成玻璃。玻璃有普通玻璃、石英玻璃、光学玻璃等。玻璃没有固定的熔、沸点。
3、陶瓷
(1)制造陶瓷的主要原料:粘土。
(2)制造陶瓷的一般过程:混合、成型、干燥、烧结、冷却、成为陶器。
(3)陶瓷的种类(根据原料、烧制温度划分):土器、陶器、瓷器、炻器等。
练11、水泥的成分主要有Ca2SiOx、Ca3SiOy、Ca3Al2Oz,则x=________,y=________,z=________,分别用氧化物表示其组成________、________、________。
解析:
根据化合物分子中各元素的化合价代数和为零这一原则,可得x=4,y=5,z=6。再将Ca2SiO4、Ca3SiO5、Ca3Al2O6改写成氧化物的形式,则得2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3。也可通过对课本中水泥主要成分的回忆,再反推x、y、z。
答案:
x=4;y=5;z=6;2CaO·SiO2;3CaO·SiO2;3CaO·Al2O3
练12、为熔制钾玻璃准备如下熔料:360份质量的石英砂,67.2份质量的苛性钾和88.8份质量的熟石灰。假定这些熔料不含杂质。
(1)计算在制得的钾玻璃中各氧化物的质量分数;
(2)用氧化物的形式表示钾玻璃的组成。
解析:
将熔料各组分的质量比换算成各组分物质的量之比即得。

答案:
(1)w(K2O)=11.7%;w(CaO)=13.9%;w(SiO2)=74.4%;(2)K2O·2CaO·10SiO2
练13、氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________________________________(填序号)。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)写出N的原子结构示意图:__________,根据元素周期律知识,请写出氮化硅的化学式__________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:__________。
(4)现用四氯化硅和氮气在氢气气氛保护下加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为____________________。
解析:
根据N和Si的原子结构及其元素周期律的知识,可判断氮元素非金属性比硅强,故N显负价(-3),Si显正价(+4),由此可写出氮化硅的化学式Si3N4;氮化硅被氢氧酸腐蚀是由于Si3N4能与HF发生化学反应,由于Si与F有极强的亲合性生成了SiF4,则反应中另一种产物为NH3;SiCl4与N2、H2反应生成的产物之一为Si3N4,另一种产物必是HCl。此反应可理解为H2还原SiCl4制取硅,然后Si与N2在高温条件下反应生成Si3N4。
答案:
(1)A、C、D (2) Si3N4
Si3N4
(3)Si3N4+12HF=3SiF4+4NH3
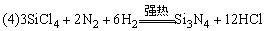
例1、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对下图中指定部位颜色描述正确的是( )
| |
① |
② |
③ |
④ |
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
B |
无色 |
橙色 |
紫色 |
白色 |
C |
黄绿色 |
橙色 |
蓝色 |
无色 |
D |
黄绿色 |
无色 |
紫色 |
白色 |
解析:
氟气:淡黄绿色,氯气:黄绿色,氯水:黄绿色,液溴:深棕红色,溴水:橙色,碘:紫色,碘水:黄色,碘的淀粉溶液:蓝色,Cl2通入NaOH溶液中生成NaCl,NaClO呈无色,但由于棉花球呈白色,故Cl2被蘸有NaOH溶液的棉球吸收后仍显白色,选A。
答案:A
例2、如下图中的四条直线分别表示钠、镁、铝、铁和足量Cl2反应消耗金属质量(纵轴)与反应掉氯气质量(横轴)的关系,其中代表铁与氯气反应的直线是( )
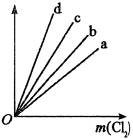
A.a B.b
C.c D.d
解析:
设35.5g Cl2即1mol Cl分别和钠、镁、铝、铁反应生成NaCl、MgCl2、AlCl3、FeCl3,所消耗Na、Mg、Al、Fe的质量分别为: 因此a、b、c、d依次代表Al、Mg、Fe、Na与Cl2反应的图象,故选C。
因此a、b、c、d依次代表Al、Mg、Fe、Na与Cl2反应的图象,故选C。
答案:C
例3、将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成的沉淀与通入CO2的量的关系可表示为( )

解析:
KOH、Ba(OH)2和KAlO2组成的混和液显强碱性,溶液中 ,通入CO2后,立即发生的反应为:
,通入CO2后,立即发生的反应为: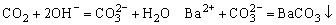 ,故一通入CO2即产生沉淀,当溶液中Ba2+全部沉淀后溶液仍呈碱性故继续通入CO2后图象上出现“平台”:
,故一通入CO2即产生沉淀,当溶液中Ba2+全部沉淀后溶液仍呈碱性故继续通入CO2后图象上出现“平台”: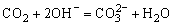 当溶液中OH-耗尽后,CO2再和
当溶液中OH-耗尽后,CO2再和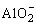 反应:
反应: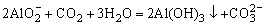 因此图象上表现为沉淀物质的量增加,当
因此图象上表现为沉淀物质的量增加,当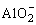 沉淀完全后,图象上又出现“平台”这是因为:
沉淀完全后,图象上又出现“平台”这是因为: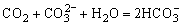 。当
。当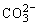 全部转化为
全部转化为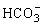 后CaCO3沉淀开始溶解:CaCO3+CO2+H2O=Ca(HCO3)2,因Al(OH)3不溶于CO2水溶液故图象上最后出现“低谷平台”。
后CaCO3沉淀开始溶解:CaCO3+CO2+H2O=Ca(HCO3)2,因Al(OH)3不溶于CO2水溶液故图象上最后出现“低谷平台”。
答案:C
例4、氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2+C+N2 Si3N4+CO
Si3N4+CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是__________,其还原产物是__________;
(3)该反应的平衡常数表达式为K=__________;
(4)若知上述反应为放热反应,则其反应热△H__________零(填“大于”“小于”或“等于”);升高温度,其平衡常数值__________(填“增大”“减小”或“不变”);
(5)若使压强增大,则上述平衡向__________反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol·(L·min)-1,则N2消耗速率为v(N2)= __________mol·(L·min)-1。
解析:

(2)因为N2、CO为气体,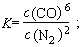
反应热用△H来表示,△H<0,升高温度,平衡向吸热方向移动,即向逆反应方向移动,K减小,增大压强,平衡向气体体积减小的方向移动,即向逆反应方向移动。速率之比等于化学计量数之比,则N2消耗速率为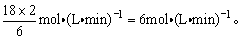
答案:
(1)3 6 2 1 6 (2)N2 Si3N4  (4)小于;减小 (5)逆 (6)6
(4)小于;减小 (5)逆 (6)6
例5、晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl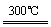 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为______________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
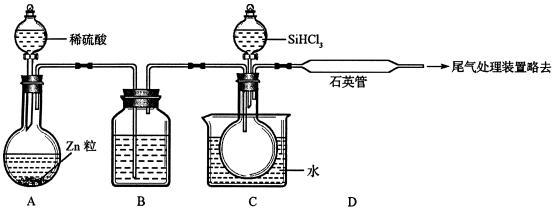
①装置B中的试剂是__________,装置C中的烧瓶需要加热其目的是_____________。
②反应一段时间后,装置D中观察到的现象是______________________________,装置D不能采用普通玻璃管的原因是________________________________________,装置D发生反应的化学方程式为________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是__________。
a.碘水 b.氯水
c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
解析:
(1)高温用C还原SiO2既使生成CO2由于C过量故高温下C又将CO2还原生成CO而不是CO2。
(2)分离、提纯不同沸点的液体可以采用分馏或蒸馏的方法。
(3)用Zn、稀H2SO4制得的H2会混有少量H2O,而SiHCl3能与H2O剧烈反应,所以要进行干燥,根据装置选择液态干燥剂浓硫酸。C装置用水浴加热SiHCl3使其挥发成气体,和H2进入D装置反应。因为 的温度很高,不能使用普通玻璃管。因为SiHCl3容易在空气中自燃,实验中还要注意先通一段时间H2排尽装置中的空气。
的温度很高,不能使用普通玻璃管。因为SiHCl3容易在空气中自燃,实验中还要注意先通一段时间H2排尽装置中的空气。
答案:
(2)分馏(或蒸馏)
(3)①浓硫酸 使滴入烧瓶中的SiHCl3气化
②有固体物质生成;在反应所需温度下,普通玻璃会软化;
③排尽装置中的空气 ④bd
例6、取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器。

实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。根据以上叙述回答问题:
(1)元素Z是__________;
(2)停止加热前是否需要先断开a和b的连接处?为什么?
(3)反应管a中发生的所有反应的化学方程式是______________________________;
(4)本实验的尾气是否需处理?如需处理,请回答如何处理:如不需处理,请说明理由。
解析:
本题打破物质推断需确定具体物质名称的常规思维。因黄色粉末状化合物MZ在N2气氛中与碳粉反应生成能使澄清石灰水变浑浊的气体CO2易推知Z元素是氧,MO是PbO在解题中可用MO表示。
答案:
(1)氧
(2)不需要,因有N2不断通入,b瓶溶液不会倒吸至a管
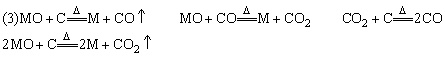
(4)需处理,因含有CO可连接一个加热的装有CuO粉末的反应管
例7、C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge原子原子结构示意简图为:____________________。
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是____________________。
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式____________________;
②SiO2晶体的空间构型及硅氧之间的成键方式____________________;
③已知SnO2是离子晶体,写出其主要物理性质____________________(写出2条即可)。
(4)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为__________。
(5)碳氧键的红外伸缩振动频率与键的强度成正比。已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度__________ (填字母)。
A.强 B.弱
C.相等 D.无法判断
解析:
Ge位于第四周期,其原子结构示意简图为: ,C、Si都是非金属元素,而Sn是金属元素,故锡为金属晶体。CO2分子为直线型,
,C、Si都是非金属元素,而Sn是金属元素,故锡为金属晶体。CO2分子为直线型,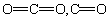 键是极性共价键。SiO2是正四面体结构,Si—O是极性共价键。SnO2是离子晶体,离子晶体有较高的熔点,熔融状态能导电。CO中有孤对电子,而Ni原予中有空轨道,Ni与CO之间形成配位键。
键是极性共价键。SiO2是正四面体结构,Si—O是极性共价键。SnO2是离子晶体,离子晶体有较高的熔点,熔融状态能导电。CO中有孤对电子,而Ni原予中有空轨道,Ni与CO之间形成配位键。
答案:
(1)
(2)Sn
(3)①直线型共价键(或σ键与π键)
②SiO原子间通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构;共价键(σ键)
③熔融时能导电、较高的熔点
(4)配位键
(5)B
例8、一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol·L-1的NaOH溶液(密度为1.12g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为__________。
(2)所得溶液中Cl-的物质的量为__________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)︰n(H2)__________。
解析:
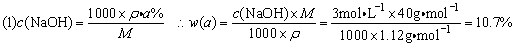
(2)溶液中含NaClO,说明H2与Cl2反应时,Cl2过量,则用NaOH吸收时发生的反应有NaOH+HCl=NaCl+H2O,2NaOH+Cl2=NaCl+NaClO+H2O,
由Na守恒得n(NaCl)+n(NaClO)=0.1L×3mol·L-1=0.3mol,所以n(Cl-)=0.3mol-0.05mol=0.25mol
(3)Cl2 + 2NaOH = NaCl + NaClO + H2O
0.05mol 0.05mol 0.05mol
n(HCl)=0.25mol - 0.05mol = 0.20mol
H2 + Cl2 = 2HCl HCl + NaOH = NaCl + H2O
0.1mol 0.1mol 2mol 0.20mol 0.20mol
所以n(H2)︰n(Cl2)=0.1mol︰(0.1+0.05)mol=2︰3
所以n(Cl2)︰n(H2)=3︰2