(一)复习要点阐述
1、本专题知识内在联系

2、要点复习的策略及技巧
(1)原电池
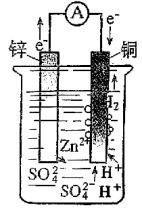
采用如图所示的装置。在甲杯中放入ZnSO4溶液并插入锌片,在乙杯中放入CuSO4溶液并放入铜片,把两个烧杯中的溶液用一个装满氯化钾琼脂的U形管(称为盐桥)连接起来,这时电流计的指针开始偏转,同时锌片开始溶解。而铜片上有铜析出。这种利用氧化还原反应把化学能转变成电能的装置叫做原电池。对于原电池应掌握如下3点。

①电极名称:
(a)外电路:电子定向移动的路线
宏观判断:较活泼的金属是负极,较不活泼的电极材料(金属或合金、非金属)是正极。
正、负极划分依据:电子的流向
(b)内电路:电解质溶液中离子定向移动的路线。
阳极:阴离子趋向的极。
阴极:阳离子趋向的极。
②划分依据:离子定向移动。
电极反应方程式:
正极(铜片):Cu2++2e-=Cu(还原反应)
负极(锌片):Zn-2e-=Zn2+(氧化反应)
总反应方程式:Zn+CuSO4=ZnSO4+Cu
③构成原电池的条件:
有两种活泼性不同的电极材料与电解质溶液接触。如含有杂质的金属与电解质溶液接触时则形成很多微电池。
(2)金属的腐蚀与防护
负极(Fe):2Fe-4e-=2Fe2+正极(C):2H2O+O2+4e-=4OH-
而金属的防护则是杜绝金属发生氧化还原反应。可采用改变金属内部组织结构,在金属表面覆盖保护层等方法。
①化学腐蚀与电化腐蚀
| |
化学腐蚀 |
电化腐蚀 |
含义 |
金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程 |
不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程 |
电子
得失 |
金属直接将电子转移给有氧化性的物质 |
活泼金属将电子间接转移给氧化性较强的物质 |
电流 |
无电流产生 |
有微弱电流产生 |
实例 |
金属与Cl2、O2、H2SO4等物质直接反应
2Fe+3Cl2=2FeCl3 |
钢铁在潮湿空气中被腐蚀。
负极:2Fe-4e-=2Fe2+
正极:2H2O+O2+4e-=4OH- |
②金属腐蚀的防护方法:
a.改变金属的内部组织结构;b.在金属表面覆盖保护层;c.电化学保护法。
(3)几种常见的化学电源
①干电池
电极反应:负极(Zn)Zn-2e-=Zn2+
正极(C) +2MnO2+2e-=2NH3+Mn2O3+H2O
+2MnO2+2e-=2NH3+Mn2O3+H2O
电池总反应式:Zn+2MnO2+2NH4Cl=ZnCl2+Mn2O3+2NH3+H2O
②铅蓄电池
电极反应:负极(Pb)Pb+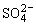 -2e-=PbSO4
-2e-=PbSO4
正极(PbO2)PbO2+4H++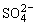 +2e-=PbSO4+2H2O
+2e-=PbSO4+2H2O
电池总反应式:Pb+PbO2+2H2SO4=2PbSO4+2H2O
③锂电池
电极反应:负极(Li)2Li-2e-=2Li+
正极I2+2e-=2I-
电极总反应式:2Li+I2=2LiI
④燃料电池
氢氧燃料电池,40%的KOH为电解质溶液
电极反应:负极(H2):
2H2-4e-+4OH-=4H2O
正极(O2):O2+2H2O+4e-=4OH-
电池总反应式:2H2+O2=2H2O
甲烷燃料电池、KOH溶液为电解质溶液
负极(CH4):CH4+10OH--8e-=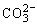 +7H2O
+7H2O
正极(O2):2O2+4H2O+8e-=8OH-
电池总反应式:CH4+2O2+2KOH=K2CO3+3H2O
⑤铝——空气燃料电池
电极反应:负极:4Al-12e-=4Al3+
正极:3O2+6H2O+12e-=12OH-
电池总反应式:4Al+3O2=2Al2O3
⑥镍镉可充电原电池
负极(Cd):Cd-2e-+2OH-=Cd(OH)2
正极:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-
NiO(OH)化学名称为:羟基镍酰结构式为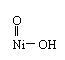 镍显+3价
镍显+3价
总反应式为:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
⑦银锌电池(钮扣电池)
电极材料:负极:Zn正极:Ag2O
电解质溶液:KOH溶液
电极反应:负极:Zn-2e-+2OH-=ZnO+H2O
正极:Ag2O+2e-+H2O=2Ag+2OH-
总反应:Zn+Ag2O=ZnO+2Ag
(4)电解池及电解原理
将连接电源正负极的两电极材料插入电解质溶液便组成电解池。电解池是将电能转变成化学能的装置。
①电极名称:

②阴、阳离子放电规律:
阴、阳离子失去或得到电子的过程叫放电。
a.活性材料(即金属Zn,Cu,Fe,Ag等)作阳极时则该活性材料溶解。因为构成该活性材料的金属原子失电子的能力比阴离子要强。
b.惰性材料(如石墨、铂、金等)作阳极时,溶液中阴离子放电顺序为:S2->I->Br->Cl->OH->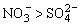
③无论是活性材料,还是惰性材料作阴极,都不参与电极反应。溶液中阳离子放电顺序为:
Au3+>Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)用惰性电极电解时溶液中变化情况简析
类型 |
电极反应特点 |
实例 |
电解
对象 |
电解质
浓度 |
pH值 |
电解质
溶液复原 |
电解
水型 |
阴极:4H++4e-=2H2
阳极:4OH--4e-=2H2O+O2 |
NaOH |
水 |
增大 |
增大 |
加水 |
H2SO4 |
水 |
增大 |
减小 |
加水 |
Na2SO4 |
水 |
增大 |
不变 |
加水 |
分解电
解质型 |
电解质电离出的阴阳离子分别在两极放电 |
HCl |
电解质 |
减小 |
增大 |
加氯化钠 |
CuCl2 |
电解质 |
减小 |
|
加氯化铜 |
放出
H2生
碱型 |
阴极:H2O分解放出H2生成碱
阳极:电解质阴离子放电 |
NaCl |
电解质
和水 |
生成新
电解质 |
增大 |
加氯化氢 |
放O2
生酸型 |
阴极:电解质阳离子放电
阳极:H2O分解放O2生成酸 |
CuSO4 |
电解质
和水 |
生成新
电解质 |
减小 |
加氧化铜 |
3、综合复习应明确的几个问题
(1)原电池的两个电极是否必须有一个与电解质溶液自发发生氧化还原反应?
答:不一定。原电池的电极材料是否参与反应有如下3种情况:
①仅有一个电极参与反应。例如钢铁的电化腐蚀。
负极:2Fe-4e-=2Fe2+
正极:2H2O+O2+4e-=4OH-
铝-空气海水电池
负极(Al):4Al-12e-=4Al3+
正极:6H2O+3O2+12e-=12OH-
②两个电极均参与反应。铅蓄电池
负极(Pb):Pb-2e-+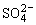 =PbSO4
=PbSO4
正极(PbO2):PbO2+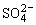 +4H++2e-=PbSO4+2H2O
+4H++2e-=PbSO4+2H2O
总反应方程式:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
③两个电极均不参与反应
例如阿波罗宇宙飞船用的氢氧燃料电池正负极材料均为多孔碳电极(负极填充铂粉钯粉正极填充Co、Au、Ag等氧化物)
负极(多孔碳电极):2H2-4e-+4OH-=4H2O
正极(多孔碳电极):2H2O+O2+4e-=4OH-
(2)怎样书写燃料电池的电极反应方程式?
a.碱性燃料电池的正极反应方程式是:2H2O+O2+4e-=4OH-,这是解题的切入点,然后由总反应方程式减正极反应方程,得负极电极反应方程式。
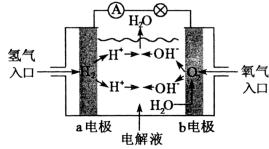
①氢氧燃料电池
负极:2H2+4OH--4e-=4H2O
正极:2H2O+O2+4e-=4OH-
总反应:2H2+O2=2H2O
②CH4燃料电池CH4|KOH(aq)|O2
负极:CH4+10OH--8e-= +7H2O
+7H2O
正极:2CH4+4O2+8e-=2CO2+4H2O
总反应方程式:CH4+2O2=CO2+2H2O
③丁烷燃料电池C4H10|K2CO3|O2
负极:2C4H10+ -52e-=34CO2+10H2O
-52e-=34CO2+10H2O
正极:26CO2+13O2+52e-=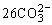
总反应方程式:2C4H10+9O2=8CO2+10H2O
燃料电池电子流向:
负极 正极→阴离子在正极得e-
正极→阴离子在正极得e-
阴离子在负极失e-→负极
O2在燃料电池中总是作正极,若电解质为水溶液则O2转化为OH-,若电解质为熔融盐则O2转化为O2-。
(3)原电池的正、负极能否叫作阴、阳极?
1)电极名称:
(a)外电路:电子定向移动的路线
宏观判断:较活泼的金属是负极,较不活泼的电极材料(金属或合金、非金属)是正极。
正、负极划分依据:电子的流向
(b)内电路:电解质溶液中离子定向移动的路线。
阳极:阴离子趋向的极。
阴极:阳离子趋向的极。
划分依据:离子定向移动。
(4)在用惰性电极电解电解质溶液时涉及到有关于水的电极反应能否将其概括为H+在阴极放电,OH-在阳极放电?
答:不能这样概括。这是因为用惰性电极电解某些实质上是电解水的电解质溶液时要考虑溶液中离子的浓度对放电顺序的影响。
例如:用惰性电极电解1mol·L-1NaOH溶液时,写出阴、阳两极上发生反应的电极反应方程式。
阳极:4OH--4e-=2H2O+O2↑
阴极:4H++4e-=2H2↑
阳极电极反应方程式无疑是正确的。但阴极反应方程式就不能反映电解的本质。因为在阴极附近H2O的c(H2O)=55.6mol·L-1,而1mol·L-1NaOH溶液中c(H+)=1×10-141mol·L-1。有理由认为H+在阴极的放电行为相对于水是不重要的。所以阴极电极反应方程式为:4H2O+4e-=2H2↑+4OH-。
综上所述,可归纳如下:
(1)用惰性电极电解稀的强酸强碱盐溶液、稀的强碱溶液、稀H2SO4等溶液。
阴极:4H++4e-=2H2↑
阳极:4OH--4e-=2H2O+O2↑
(2)若题给信息强调电解质溶液浓度是等于或大于1mol·L-1,其实质是电解水的某些电解质溶液时,电极反应方程式应写成:
阳极:4OH--4e-=2H2O+O2↑
阴极:4H2O+4e-=2H2↑+4OH-
(5)电解电解质溶液时,含氧酸根一定不参加电极反应吗?
不一定。例如:工业上制备KMnO4生产流程如下:
①将MnO2KOH粉碎混和在空气中加热熔化并不断搅拌以制取K2MnO4。
②电解K2MnO4浓溶液在阳极得到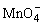 ,在阴极放出H2。
,在阴极放出H2。
写出流程①的化学反应方程式,流程②的电极反应方程式和总反应化学方程式。
解:
①2MnO2+4KOH+O2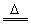 2K2MnO4+2H2O
2K2MnO4+2H2O
②阴极:4H2O+4e-=2H2↑+4OH-
阳极: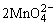 -2e-=
-2e-=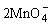
2K2MnO4+2H2O 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
(6)氯碱工业中,电解的食盐水为什么必须是饱和溶液?
①降低Cl2在水中的溶解度,从而减少副反应的发生。
②采用饱和食盐水,可以提高溶液的电导率。
③采用饱和食盐水,可使Cl2析出电位降低,从而防止OH-放电,以析出O2。
例1、下列各装置是原电池的写出电极反应方程式,不是原电池的说明理由。
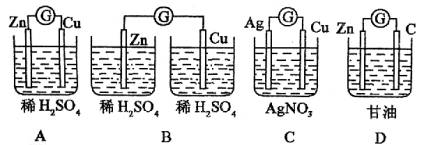
解析:
装置A是原电池。电极反应方程式是:负极(Zn):Zn-2e-=Zn2+;正极(Cu):2H++2e-=H2↑。装置B无内电路,故不能构成原电池。装置C是原电池。电极反应方程式是:负极(Cu):Cu-2e-=Cu2+;正极(Ag):2Ag++2e-=2Ag。D装置中甘油不是电解质,故不是原电池。
例2、分别放在以下装置(都盛有0.1 mol·L-1H2SO4溶液)中的4块相同的纯锌片,其中腐蚀最快的是( )
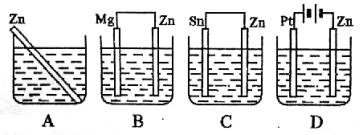
解析:
在稀酸溶液中,两种金属用导线相连,活泼金属失去电子被氧化而腐蚀加快,本题中要使纯锌腐蚀最快,应选择某种不活泼金属跟纯锌相连接,选项C满足此条件,可加速纯锌的腐蚀。选项B中锌与镁相连,金属镁受腐蚀,锌受保护。选项D中是一电解装置,连接锌的是电源的负极,在电解中称为阴极,发生还原反应,可使H+获得电子还原成氢气,它可保护金属锌不易受腐蚀。
答案:C
例3、为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的纯铁棒分别固定在如图所示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是( )
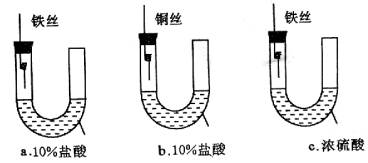
A.装置a的左侧液面一定会下降
B.左侧液面装置a比装置b的低
C.装置b中的铁钉腐蚀最严重
D.装置c中的铁钉几乎没被腐蚀
解析:
化学上所说的铁丝、铁钉、铜丝均为纯净物不含杂质,故装置a中发生化学腐蚀消耗O2,左侧液面上升,装置b发生析氢腐蚀,左侧液面下降,装置c中铁钉几乎不被腐蚀。
答案:B
例4、X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:

(1)Z2Y的化学式是____________。
(2)Z2Y2与X2Y反应的化学方程式是____________。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)、C(Ⅱ)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(I)的电极名称是____________(填“正极”或“负极”);C(Ⅱ)的电极反应式是____________。
(4)铜屑放入稀H2SO4中不发生反应。若在稀H2SO4中加入X2Y2铜屑可逐渐溶解,该反应的离子方程式是________________________。
解析:
此题的突破口在于X2Y型的共价化合物和Z2Y2型的离子化合物,很容易联想到H2O2和Na2O2,而原子序数W>Z,即在11号Na后面的短周期元素中能形成ZW的即为NaCl,故X:H Y:O Z:Na W:Cl
(1)Z2Y的化学式即Na2O
(2)Z2Y2与X2Y反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑
(3)当接通S1,断开S2时,装置为电解池:
C(I)附近;阴极:2H++2e-=H2↑,溶液呈碱性
C(Ⅱ)附近:阳极:2Cl--2e-=Cl2↑
由于H2、Cl2的产生使C(I)、C(Ⅱ)上形成气室。当接通S2,断开S1时,装置为原电池,由此联想到氢氧燃料电池,此时利用的是H2+Cl2=2HCl这个氧化还原反应,显然:
负极(氧化反应):C(I)附近:H2-2e-+2OH-=2H2O
正极(还原反应):C(II)附近:Cl2+2e-=2Cl-
故答案为:C(I)的电极名称是:负极。C(II)的电极反应式是:Cl2+2e-=2Cl-
(4)Cu+H2O2+2H+=Cu2++2H2O
答案:(1)Na2O
(2)2Na2O2+2H2O=4NaOH+O2↑
(3)负极;Cl2+2e-=2Cl-
(4)Cu+H2O2+2H+=Cu2++2H2O
例5、氯碱厂电解饱和食盐水制取NaOH的工艺流程如图所示。
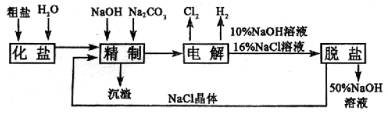
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为____________。与电源负极相连的电极附近,溶液pH____________(选填“不变”“升高”或“降低”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应应的离子反应方程式为____________。
(3)如果粗盐中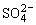 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是____________ (选填a,b,c)。
,该钡试剂可以是____________ (选填a,b,c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、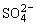 ,加入试剂的合理顺序为____________ (选填a,b,c)。
,加入试剂的合理顺序为____________ (选填a,b,c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过____________、冷却、____________除去NaCl。(填写操作名称)
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为____________。
解析:
与电源正极相连的电极是电解池的阳极,应是溶液中的Cl-发生氧化反应,而电解池的阴极反应为2H++2e-=H2↑,阴极附近c(H+)减小,导致水的电离平衡破坏,使阴极周围c(OH-)增大。第(2)问中如何除Ca2+、Mg2+,由题中信息,这步加了NaOH、Na2CO3溶液,根据Ca2+、Mg2+的特性,加NaOH是为将Mg2+转化为Mg(OH)2沉淀而除去,加Na2CO3是为将Ca2+转化为CaCO3沉淀而除去。第(3)问要遵循除杂质不能引进新的杂质的原则,因此Ba(NO3)2不能加入,而题中BaCl2、Ba(OH)2两种试剂皆可。第(4)问考虑问题的出发点是为使杂质离子“除净”,所加试剂均应“稍过量”,为使后加试剂有利于除去先加试剂而导致的过量离子,应把加入NaCO3放在加入钡试剂之后,而钡试剂与NaOH加入的先后顺序可以颠倒。第(5)问分析题中信息,脱盐前为10%NaOH、16%NaCl溶液,脱盐后为50%NaOH溶液和NaCl晶体,显然需要蒸发、过滤。第(6)问,因电解得到的Cl2与NaOH反应,可将NaCl电解方程式与Cl2和NaOH反应的方程式合并。
答案:
(1)2Cl--2e-=Cl2;升高
(2)Ca2++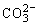 =CaCO3↓,Mg2++2OH-=Mg(OH)2↓
=CaCO3↓,Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)bc
(5)蒸发;过滤
(6)NaCl+H2O NaClO+H2↑或2NaCl+2H2O
NaClO+H2↑或2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
Cl2+2NaOH=NaCl+NaClO+H2O
例6、铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++ 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
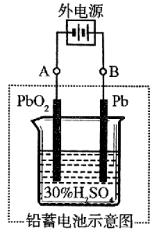
(1)放电时:正极的电极反应式是_________;电解液中H2SO4的浓度将变_________;当外电路通过1 mol电子时,理论上负极板的质量增加_________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成_________、B.电极上生成_________,此时铅蓄电池的正负极的极性将_________。
解析:
原电池里正极上得电子,负极上失电子。根据电池总反应式,正极反应为:PbO2+2e-+4H++ =PbSO4+2H2O。
=PbSO4+2H2O。
负极反应为:
Pb-2e-+ =PbSO4 质量增加
=PbSO4 质量增加
2 mol 96 g
1 mol △m
求得△m=48 g。
电解池里与电源正极相连的电极(阳极)上失电子,与电源负极相连的电极(阴极)上得电子。则阳极反应为PbSO4-2e-+2H2O=PbO2+4H++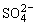 ;阴极反应为PbSO4+2e-=Pb+
;阴极反应为PbSO4+2e-=Pb+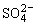 。根据图示,电解一段时间后,原PbO2极(阴极)变成Pb,原Pb极(阳极)变成PbO2,即正负极对换。
。根据图示,电解一段时间后,原PbO2极(阴极)变成Pb,原Pb极(阳极)变成PbO2,即正负极对换。
答案:
(1) PbSO4+2e-+4H++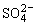 =PbSO4+2H2O ;小; 48
=PbSO4+2H2O ;小; 48
(2)Pb; PbO2;对换
例7、将1L一定浓度的CuSO4溶液,用a、b两石墨电极电解,当a极上产生22.4L(标准状况)气体时,b极上仍有金属析出,然后将a、b极电源反接,继续通直流电,当b极上又产生22.4L(标准状况)气体时,溶液质量共减少227g,求:
(1)a极上产生22.4L(标准状况)气体时,b极增加的质量;
(2)求原溶液的物质的量浓度。
解析:
(1)过程①2CuSO4+2H2O=2H2SO4+2Cu+O2↑
2mol 22.4L
析出m(Cu)=2mol×64g·mol-1=128g
(2)过程②反接电源
b作阳极:Cu-2e-=Cu2+后有:4OH--4e-=2H2O+O2↑
a作阴极:Cu2++2e-=Cu后可能有:2H++2e-=H2↑
设原溶液中CuSO4为x mol,a极可能产生H2 ymol
b极共失e-:2×2mol+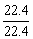 ×4=8mol
×4=8mol
a极共得e-:2x+2y=8mol
由此可列方程组:
