1、 过氧化氢的分子结构
过氧化氢是含有极性键和非极性键的极性分子,其结构式为H—O—O—H,电子式为: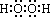
2、 过氧化氢的物理性质
过氧化氢是一种无色黏稠的液体,它的水溶液俗称双氧水。
3、 过氧化氢的化学性质
(1)H2O2是二元弱酸,具有酸性

(2)氧化性
H2O2+2KI+2HCl=2KCl+I2+2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
H2O2+H2S=S↓+2H2O
H2O2+SO2=H2SO4
注:在酸性条件下H2O2的还原产物为H2O,在中性或碱性条件其还原产物为氢氧化物.
(3)还原性
2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O
H2O2+Cl2=2HCl+O2
注:H2O2的氧化产物为O2
(4)不稳定性

4、 H2O2的保存方法
实验室里常把H2O2装在棕色瓶内避光并放在阴凉处。
5、 H2O2的用途
作消毒、杀菌剂,作漂白剂、脱氯剂,H2O2还可作火箭燃烧的氧化剂等。
1、 SO2的物理性质
(1)无色、有刺激性气味的有毒气体;
(2)密度比空气大,易液化,沸点为-10℃;
(3)易溶于水,常温常压下,1体积水大约能溶解40体积的SO2。
2、 SO2的化学性质
(1)SO2属酸性氧化物,具有酸性氧化物的一切通性

(2)较弱的氧化性——还原产物为S
SO2+2H2S=3S+2H2O(气体或溶液中均可进行)
(3)较强的还原性——氧化产物为SO3、H2SO4或硫酸盐
常见的氧化剂有Cl2、Br2、I2、KMnO4/H+、HNO3、Fe3+、O2等,故SO2能使溴水和酸性KMnO4溶液褪色。
SO2+X2+2H2O=H2SO4+2HX (X=Cl、Br、I)
2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl
2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
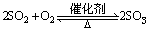
(4)漂白性
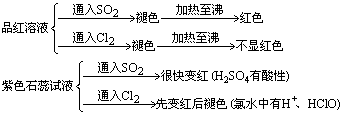
SO2的漂白原理:SO2溶于水生成H2SO3,H2SO3跟某些有色物直接化合生成不稳定的无色化合物[该物质在一定条件下(如加热)可分解,使物质又恢复原来的颜色]
O3、HClO、Na2O2、HClO的漂白原理:它们可将有色物质氧化成稳定的无色物质[该物质一般不会转化为原来有色的物质]
另外,活性炭具有强的吸附性能,也能使一些有色物质褪色。
3、 SO2的制备
工业制法
燃烧硫或煅烧金属硫化物制取SO2。

实验室制法
(1)反应原理:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(2)反应装置:固+液→气
(因为Na2SO3是粉未状的固体,易溶于水,故不能用启普发生器制SO2)
(3)收集方法:向上排空气法
(4)检验SO2:品红溶液(若溶液褪色,即可证明气体成分为SO2)
(5)验满:湿润的蓝色石蕊试纸(若变红,即可证明收集满了SO2)
(6)尾气吸收:碱液(如NaOH溶液)
4、 SO2的用途
制H2SO4;可作漂白剂,漂白纸浆、毛、丝、草编制品等;杀灭霉菌和细菌,作食物和干果的防腐剂。
5、 SO2对环境的污染
(1)酸雨的形成
正常的雨水由于溶解CO2形成弱酸H2CO3,pH约为5.6。酸雨的形成是一种复杂的大气化学和大气物理过程。一般认为,酸雨是由于人为排放的SO2等酸性气体进入大气后,造成局部地区大气中的二氧化硫富集,在水凝结过程中溶解于水形成亚硫酸,然后经某些污染物的催化作用及氧化剂的氧化作用生成硫酸,随雨水降下形成酸雨。酸雨中的酸度主要是由H2SO4和HNO3造成的,pH<5.6。
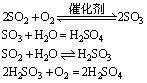
(2)SO2的来源
空气中的SO2主要来自化石燃料(如煤等)的燃烧,以及含硫矿石(如FeS2等)的冶炼和硫酸、磷肥、纸浆生产等产生的工业废气。
(3)净化与回收
由于SO2有毒,无论是工业制取还是实验室制取或使用SO2时,多余的气体必须吸收处理(如NH3·H2O、NaOH等),以免污染环境。
6、 亚硫酸及亚硫酸盐
SO2溶于水,所得溶液称为亚硫酸。H2SO3是二元中强酸,电离方程式为:
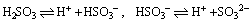
H2SO3酸性比H2CO3强。H2SO3只存在于水溶液中,容易分解为SO2和H2O。H2SO3在空气中容易被空气中的O2氧化,使溶液的酸性增强。
亚硫酸盐具有还原性,容易被空气中O2氧化。如Na2SO3露置在空气中变质的化学方程式为2Na2SO3+O2=2Na2SO4
H2SO3与H2S可发生反应,H2SO3+2H2S=3S↓+3H2O。SO32-与S2-在中性或碱性条件下可共存,但在酸性条件下不能共存,相关离子方程式为:
SO32-+S2-+6H+=3S↓+3H2O
7、 SO2与CO2比较
相同点:均能使澄清石灰水变浑浊,过量时溶液又变澄清了。
不同点:SO2有刺激性气味,而CO2无味;SO2能使溴水、酸性KMnO4溶液、品红溶液褪色,而CO2不能。