|
一、一周内容概述
化学反应可从不同的角度分类,根据反应物和生成物的类别以及反应前后物质种类的多少可分为化合反应、分解反应、置换反应、复分解反应,根据反应中是否有电子转移可分为氧化还原反应和非氧化还原反应,根据反应中是否有离子参加可分为离子反应和分子反应。本周讲述离子反应,内容包括电解质和非电解质,强电解质和弱电解质,电解质溶液的导电性,离子反应的定义、实质、类型、发生条件等。
二、重点难点知识剖析
(一)电解质和非电解质
1、电解质和非电解质
电解质:在水溶液或熔融状态下能导电的化合物,包括酸、碱、盐及部分氧化物(如Na2O、CaO、Al2O3等)。
非电解质:在水溶液或熔融状态下都不导电的化合物,包括大多数有机物、部分氧化物(如CO、CO2、SO2、SO3等),部分气态氢化物(如CH4、NH3、PH3等)。
2、电离和电离方程式
电离:电解质溶于水或受热熔化时,离解成自由移动离子的过程。
电离方程式:用离子符号和化学式表示电解质电离的式子。
3、几个注意的问题
(1)单质既不是电解质也不是非电解质;
(2)电离是电解质溶液导电的前提;
(3)能导电的物质不一定是电解质(如石墨等),不能导电的物质不一定是非电解质(如氯化氢等);
(4)电解质本身不一定能导电(如食盐晶体);
(5)有些化合物的水溶液能导电,但它们不属电解质(如CO2、SO2、SO3、NH3等)。原因是并非它们本身能电离出自由移动离子,而是它们与水反应的生成物(如H2CO3、H2SO3、H2SO4、NH3·H2O)电离出自由移动的离子而导电。
(二)强电解质和弱电解质
1、比较:
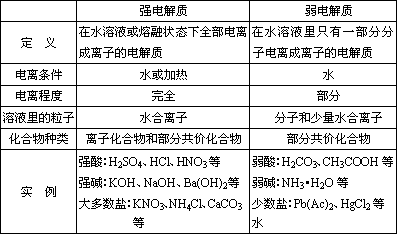
2、常见酸、碱、盐的电离方程式。
(1)由于强电解质在电离条件下完全电离成离子,没有分子,故在电离方程式中用“=”。
如:NaCl=Na++Cl-
NH4HCO3=NH4++HCO3-
HCl=H++Cl-
H2SO4=2H++SO42-(多元强酸一步电离)
Ba(OH)2=Ba2++2OH- (多元强碱一步电离)
NaHSO4=Na++H++SO42- (水溶液)
NaHSO4=Na++HSO4- (熔融状态)
(2)由于弱电解质在电离条件下部分电离成离子,体系中还有未电离的分子,故在电离方程式中用“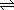 ”。 ”。
如:CH3COOH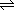 CH3COO-+H+ CH3COO-+H+
H2CO3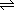 H++HCO3- H++HCO3-
HCO3- H++CO32-(多元弱酸分步电离) H++CO32-(多元弱酸分步电离)
NH3·H2O NH4++OH- NH4++OH-
Cu(OH)2 Cu2++2OH-(多元弱碱电离一步完成) Cu2++2OH-(多元弱碱电离一步完成)
3、电解质溶液的导电性
(1)导电原因
一是电解质在一定条件(水或加热熔化)下电离出自由移动的离子;
二是在外加电场作用下,阴、阳离定向移动。
(2)影响导电性强弱的因素。
一是在相同条件下溶液中自由移动离子的的浓度;
二是离子所带的电荷。
在相同条件下,溶液中自由移动离子浓度越大,离子所带的电荷数越多,溶液的导电性越强。
4、几个注意的问题
(1)溶液导电性的强弱与电解质的强弱没有必然联系。
(2)难溶性盐(如CaCO3、BaSO4等)一般属于强电解质。原因是尽管它们在水中的溶解度极小,导电性很差,但由于它们是离子化合物,在水溶液中溶解的那部分完全电离。
(三)离子反应
1、定义:凡是有离子参加或生成的反应叫离子反应。
2、离子反应的实质:通过反应使溶液中某些离子的数目或浓度明显减小。
3、离子反应的类型及发生条件。

三、典型例题
例1、将SO3溶于水所形成的水溶液能导电,SO3是否为电解质呢?
解析:化合物SO3为非电解质.电解质与非电解质的本质区别是在电离条件下是否电离.能电离的,电离后导电,是电解质;不能电离的,不导电,是非电解质.SO3无论是在熔化状态下还是在水溶液里,均不能电离,所以SO3是非电解质.SO3溶于水所形成的水溶液能导电,是SO3与H2O反应生成了H2SO4,H2SO4是电解质,使溶液导电,并非SO3的水溶液导电.像SO3这样的化合物还有CO2、SO2、P2O5等.
例2、像CaCO3这样的难溶于水、高温下能分解的盐,属于强电解质还是属于弱电解质呢?
解析:CaCO3跟其它大多数盐一样,是强电解质.区别强电解质和弱电解质,就是看电解质在电离条件下是否完全电离.CaCO3难溶于水,但不是绝对不溶于水.在25℃的条件下,CaCO3的溶解度为1.4×10-3g.CaCO3在常压,约900℃下发生分解反应,在约1.4×105Pa,1339℃下熔化.CaCO3是由Ca2+、CO32-两种离子组成的离子化合物,离子化合物在熔化状态下或溶于水的部分均完全电离,CaCO3的电离方程式为:
CaCO3=Ca2++CO32-
据上述可知,CaCO3是强电解质.同理,BaSO4、BaCO3、Mg(OH)2等也是强电解质.
- 返回 -
|