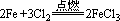
现象:铁丝在氯气里剧烈燃烧,瓶里充满棕色烟,加少量水后,溶液呈黄色。
注意: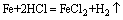 ,由FeCl3和FeCl2中铁元素的化合价可知,氧化性Cl2比HCl强。
,由FeCl3和FeCl2中铁元素的化合价可知,氧化性Cl2比HCl强。
2、与非金属的反应
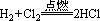
现象:H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口处出现白雾。
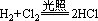
现象:见光爆炸,有白雾产生。
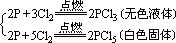
现象:磷在氯气里燃烧起来,产生大量的白色烟雾。
(1)烟与雾
烟是由大量固体小颗粒悬浮于空气中形成的;而雾是由大量小液滴悬浮于空气中形成的。
(2)燃烧
燃烧不一定要有氧气参加,任何发光、发热的剧烈的化学反应,都可以叫燃烧。
(3)爆炸的原因
在极短的时间放出大量的热,在有限的空间里气体体积急剧膨胀。
3、与水的反应
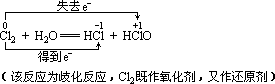
(1)氯水的组成
氯气的水溶液叫氯水。在常温下,1体积水约溶解2体积氯气,溶解的氯气中只有一部分与水反应。

(2)次氯酸的性质
①不稳定性
 故久制的氯水即为稀盐酸。
故久制的氯水即为稀盐酸。
②强氧化性
能消毒、杀菌,还能使某些染料和有机色素褪色。
③弱酸性
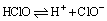
酸性极弱,比H2CO3酸性还弱。
(3)氯水的主要性质
① Cl2的强氧化性
实验室常用新制的氯水代替 Cl2做一部分实验;Cl2无漂白性。
② HCl的酸性
能使紫色石蕊试液变红。
③ HClO的强氧化性
有漂白性,能使紫色石蕊试液先变红后褪色。
(4)氯水的保存:在阴凉处用棕色试剂瓶密封保存。
4、与碱的反应
(1)吸收Cl2:Cl2+2NaOH=NaCl+NaClO+H2O
(2)漂白精:工业上用Cl2与石灰乳(含水量略少于1%)反应
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
①漂白精的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2。
②漂白原理:
Ca(ClO)2+2HCl= CaCl2+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
以上可看成强酸制弱酸, HClO的酸性比H2CO3、HCl弱。
③久置失效的原因
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
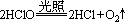
④漂白精的保存:要求密封、避光。
(3)与浓碱在加热条件下反应
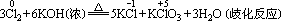
5、与某些还原性化合物的反应
2FeCl2+Cl2=2FeCl3
(三)、氯气的用途
1、用于消毒——利用HClO强氧化性
2、制盐酸——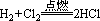 ,HCl溶于水即得盐酸
,HCl溶于水即得盐酸
3、制漂白剂
4、制有机溶剂(如氯仿即CHCl3)、多种农药(如六六六即C6H6Cl6)