(一)、卤化氢
1、HX的性质
(1)通常均为无色、有刺激性气味的气体,均易溶于水(在空气中可形成白雾),水溶液称为氢卤酸。
(2)热稳定性:HF>HCl>HBr>HI
还原性: HI>HBr>HCl>HF
注: HF、HCl可用浓H2SO4干燥、制备,而HBr、HI不可用浓H2SO4干燥、制备,因为可发生反应2HX+H2SO4(浓)=X2+SO2↑+2H2O(X=Br、I)
(3)酸性: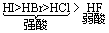
其中氢氟酸与氟化氢均有毒,它的特性是常温下可溶解 SiO2和Si。
SiO2+4HF=SiF4↑+2H2O(腐蚀玻璃)
Si+4HF=SiF4↑+2H2↑
2、HX的实验室制备
原理:利用不挥发性酸制挥发性酸。
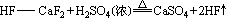
注:(1)CaF2不溶于水,俗称“萤石”,呈绿色。
(2)HF在铅皿中制取,氢氟酸保存在塑料瓶中。
(3)HF可雕刻玻璃(化学玻璃仪器工厂制量筒、滴定管等有刻度的仪器,就使用了HF)。
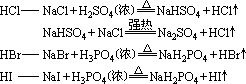
(二)、 X-的检验
1、Cl-的检验
在待测液中加入 HNO3酸化的AgNO3溶液,若有白色沉淀生成,则原待测液中含有Cl-。(HNO3可排除SO32-、CO32-、SO42-等的干扰)
离子方程式为 Cl-+Ag+=AgCl↓。
2、Br-的检验
方法一:在待测液中加入 HNO3酸化的AgNO3溶液,若有浅黄色沉淀生成,则原待测液中含有Br-。(HNO3可排除PO43-的干扰)
离子方程式为 Br-+Ag+=AgBr↓
方法二:在待测液中先滴加氯水,再加 CCl4,振荡、静置,若溶液分层,且下层为橙红色,则原待测液中含有Br-。
离子方程式为 Cl+2Br-=Br2+2Cl-
3、I-的检验
方法一:在待测液中加入 HNO3酸化的AgNO3溶液,若有黄色沉淀生成,则原待测液中含有I-。(HNO3可排除PO43-的干扰)
离子方程式为 Ag++I-=AgI↓
方法二:在待测液中先滴加氯水,再加 CCl4,振荡、静置,若溶液分层,且下层为紫色,则原待测液中含有Br-。
离子方程式为: Cl2+2I-=I2+2Cl-
方法三:在待测液中先加淀粉溶液,再加氯水,若溶液开始呈无色,后呈蓝色,则原待测液中含有 I-。
离子方程式为 Cl2+2I-=I2+2Cl-
(三)、计算物质的量的公式
(四)、化学方程式表示的量的关系
现以磷在空气中燃烧为例
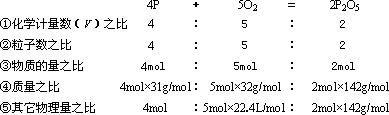
注:气体体积均指标准状况下。
在计算中应根据题意和化学方程式所能表明量的关系,选择适当的量的关系,使计算正确而简便。
(五)、计算步骤
1、设未知数
2、写出有关的化学方程式,并在有关的物质下面注明有关的量(属于多步反应的计算可建立
已知量和未知量之间的化学计量数的关系式)。
3、列出比例式求解。
4、简要写出答案。
(六)、计算要求
教学大纲(新版)对化学计算的要求更加规范、严格,具体如下:
1、根据化学方程式进行计算时,已知物质的其他物理量一般可换算成物质的量,再根据方程
式中的化学计量数之比等于物质的量之比,列出比例式。
2、要求
(1)各种符号的书写要规范,大写字母与小写字母的意义各不相同。
如 M—摩尔质量 m—质量
N—粒子数 n—物质的量
(2)设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应盐酸溶液的体积为V[HCl(aq)]。
(3)各物理量及单位、物质的名称、公式等尽量用符号表示。
如:已知 NaOH溶液的体积和物质的量浓度,求NaOH溶液的质量时,可写成m(NaOH)=C(NaOH)×V[NaOH(aq)]×M(NaOH).
(4)把已知量代入计算式中计算时要带入单位,在计算式(包括单位)中,不能出现两根分数线。
如: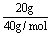 应写成
应写成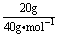
3、注意事项
(1)准确把握反应内涵(包括显露与隐含的反应),正确书写化学方程式。
(2)化学方程式所表示的是纯净物之间的量的关系,因此不纯物质必须换算成纯净物的量再进行计算。
(3)化学方程式所表示的是实际发生反应的物质之间量的关系。
如: 4mol H2与1mol O2发生反应时,反应方程式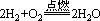 表示2mol H2与1mol O2恰好反应,因此在计算过程中不能按照4:1,而是按照2:1来计算,此例中H2过量2mol。
表示2mol H2与1mol O2恰好反应,因此在计算过程中不能按照4:1,而是按照2:1来计算,此例中H2过量2mol。
(4)在所列比例式中,同一物质上下单位要相同,不同物质左右单位要对应。