(一)物质的量浓度
1、定义:
以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
2、符号:CB
单位: mol/L或mol/m3
3、公式: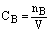
4、注意
(1)体积是指溶液的体积,而不是溶剂的体积;
(2)在一定物质的量浓度溶液中取出任意体积的溶液,其浓度不变,但所含溶质的物质的量或质量因体积的不同而不同。
(3)溶质可以是单质、化合物,也可以是离子或其他特定组合。
如 c(Cl2)=0.1mol/L c(NaCl)=2.0mol/L c(Fe2+)=0.5mol/L等。
(二)一定物质的量浓度溶液的配制
1、实验用品
除试剂外,配制中必须用到的实验用品有:容量瓶、烧杯、玻璃棒、胶头滴管,用固体配制还需用托盘天平和药匙、滤纸(或烧杯),用液体配制还需用量筒(或滴定管、移液管)。
2、配制步骤
(1)计算:计算配制所需固体溶质的质量或液体浓溶液的体积。
(2)称量:用托盘天平称量固体质量或用量筒(应用移液管,但中学阶段一般用量筒)量取液体体积。
(3)溶解:在烧杯中溶解或稀释溶质,冷却至室温(如不能完全溶解可适当加热)。
(4)转移:将烧杯内冷却后的溶液沿玻璃棒小心转入一定体积的容量瓶中(玻璃棒下端应靠在容量瓶刻度线以下)。
(5)洗涤:用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转入容器中,振荡,使溶液混合均匀。
(6)定容:向容量瓶中加水至刻度线以下1cm~2cm处时,改用胶头滴管加水,使溶液凹面恰好与刻度线相切。
(7)摇匀:盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,反复上下颠倒,使溶液混合均匀。
最后将配制好的溶液倒入试剂瓶中,贴好标签。
(三)一定物质的量浓度溶液中,溶质微粒的浓度
1、非电解质在其水溶液中以分子形式存在,溶液中溶质微粒的浓度即为溶质分子的浓度。
如 1mol/L乙醇溶液中,乙醇分子的物质的量浓度为1mol/L。
2、强酸、强碱、可溶性盐等强电解质在其水溶液中以阴离子和阳离子形式存在,各种微粒的浓度要根据溶液的浓度和溶质的电离方程式来确定。
如:1mol/L NaCl溶液中:c(Na+)=1mol/L c(Cl-)=1mol/L
1mol/L H2SO4溶液中:c(H+)=2mol/L c(SO42-)=1mol/L
1mol/L Ba(OH)2溶液中:c(Ba2+)=1mol/L c(OH-)=2mol/L
1mol/L Fe2(SO4)3溶液中:c(Fe3+)=2mol/L c(SO42-)=3mol/L
(四)关于物质的量浓度的计算
1、关于物质的量浓度概念的计算
由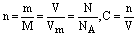
可得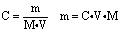
注意:其中 V指的是溶液的体积,而不是溶剂的体积。
2、溶液中溶质的质量分数与溶质的物质的量浓度的换算
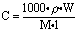
[式中:ρ—溶液的密度,单位为g/mL或g/cm3
W—溶质的质量分数
M—溶质的摩尔质量
1000—指1000mL溶液
1—指1L溶液
以下公式所用与此相同。]
推断过程:假设取 1L溶液,则:
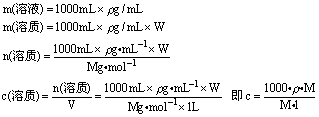

推断过程:假设取 1L溶液,则:
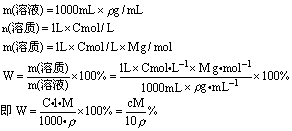
若题目中出现了溶解度 S,则可用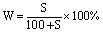 代入上两个公式,得:
代入上两个公式,得:

[式中S—某温度下的溶解度,以g为单位;100—指100g水]
3、一定物质的量浓度溶液的稀释
由溶质的物质的量在稀释前后不变得 C1V1=C2V2(C1、C2为稀释前后溶质的物质的量浓度)。
4、不同物质的量浓度溶液的混合计算
混合后溶液体积不变时 C1V1+C2V2=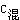 (V1+V2)。
(V1+V2)。
混合后溶液体积改变时 C1V1+C2V2=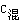
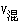 (其中
(其中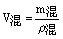 )。
)。