|
一、一周知识概述
本周讲述第一章第一节《氧化还原反应》,内容包括:化学反应的分类,从得氧和失氧观、化合价升降观、电子转移观分析氧化还原反应,找出氧化还原反应的判断依据和氧化还原的本质;氧化还原反应有关概念,如氧化剂、还原剂、氧化性、还原性、氧化产物、还原产物等;氧化还原反应中电子转移的表示方法。
二、重难点知识归纳及讲解
(一)化学反应的分类

(二)元素的化合价
元素原子的最外电子层结构决定了原子间是按一定数目相互化合,元素的原子相互化合的数目叫这种元素的化合价。
1、单质中元素的化合价为0;
2、在化合物中金属元素的化合价全为正值,非金属元素的化合价一般既有负值又有正值;
3、在化合物中,各元素的正、负化合价的代数和为0;
如:原子团的化合价:NO3-、SO42-、SO32-、HSO3-(亚硫酸氢根)、CO32-、HCO3-、ClO3-(氯酸根)、NH4+(铵根)、MnO4-(高锰酸根)、PO43-(磷酸根)。
中心元素的化合价:
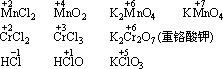
4、离子化合物中,元素的化合价与在生成它们的反应中原子得、失电子数目及离子的电荷数在数值上相等,如NaCl:

共价化合物中,元素的化合价与在生成它们的反应中共用电子对的偏向、偏离的对数在数值上相等。如HCl:
共用电子对偏向氯原子,氯元素化合价为-1价;
共用电子对偏离氢原子,氢元素化合价为+1价。
(三)氧化还原反应的特征与本质
以H2还原CuO为例
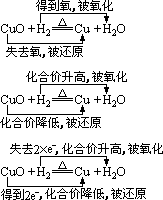
动画演示:
1、比较

2、氧化反应与还原反应同时发生,既对立又统一,在反应中化合价上升和下降总数相等,得到电子和失去电子总数相等。
3、特征(或判断依据):元素的化合价是否发生变化。
4、本质:有电子转移(得失或偏移)
5、氧化还原反应与四种基本类型反应的关系为
置换反应全部属于氧化还原反应,复分解反应全部属于非氧化还原反应,有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
例:有下列反应
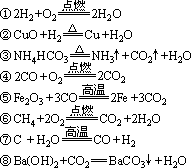
属于四种基本类型反应中:
化合反应的有①④
分解反应的有③
置换反应的有②⑦
复分解反应的有⑧
其中⑤和⑥不属于四种基本类型反应的任一种
属于氧化还原反应的有①②④⑤⑥⑦
属于非氧化还原反应的有③⑧
(四)氧化还原反应中的有关概念

联系:
氧化剂(具有氧化性)→所含元素化合价降低→得电子→被还原剂还原→发生还原反应→得还原产物。
还原剂(具有还原性)→所含元素化合价升高→失电子→被氧化剂氧化→发生氧化反应→得氧化产物。

(五)氧化还原反应中电子转移的表示方法
●双线桥法
1、双箭号从反应物指向生成物,箭号起止所指的均为同一种元素。
2、线上标出得失电子的情况及价的升降、被氧化或被还原等内容。

氧化剂为Fe2O3,还原剂为CO,氧化产物为CO2,还原产物为Fe。

氧化剂为HCl,还原剂为Zn,氧化产物为ZnCl2,还原产物为H2。
●单桥线法
1、箭号由还原剂中失电子的元素指向氧化剂中得电子的元素;
2、线上只标出转移电子的总数。
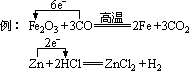
三、典型例题
例1、由物质得氧叫氧化,物质失氧叫还原的观点来分析下列化学反应属于氧化还原反应的是()
A.氢气在氧气中燃烧
B.氢气还原氧化铜
C.CO还原Fe2O3
D.石灰石和稀盐酸反应制CO2
答案:B、C
解析:
由狭义的氧化还原反应知2H2+O2=2H2O只发生氧化反应;由反应:
H2+CuO=Cu+H2O知H2转化成H2O属氧化反应,CuO转化成Cu属还原反应,故氢气还原CuO属于氧化还原反应。同理CO还原Fe2O3属于氧化还原反应;石灰石和稀盐酸反应,属复分解反应。
例2、在反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,试从氧化还原与元素化合价的升降的角度分析上述反应,并回答下列问题:
(1)___________元素被氧化,________是氧化剂。
(2)___________是氧化产物,_______发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与参加非氧化还原反应的HCl的质量比为__________。
答案:(1)HCl中-1价氯元素;KMnO4;(2)Cl2;HCl;(3)5︰3
解析:
从元素化合价升降的角度来分析氧化还原反应
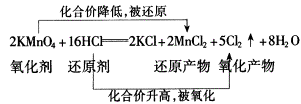
参加反应的16HCl作还原剂(化合价升高)的为10HCl。另外6HCl参加复分解反应或者说起酸的作用(KMnO4在酸性溶液中氧化性最强),故起还原剂作用的HCl与起酸性作用的HCl质量比为5︰3。
- 返回 -
|