(一)、反应物的转化率与浓度变化的关系
1、对于多种物质参加的反应的情况分析
如某反应可写为A(气)+3B(气) 2C(气)+D(气),增大A的浓度,B的转化率一定增大,而A的转化率一般是减小。
2C(气)+D(气),增大A的浓度,B的转化率一定增大,而A的转化率一般是减小。
2、对于分解反应来说,要视反应前后物质的计量数而定
如对2HI(气)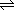 H2(气)+I2(气),不论如何改变HI的浓度,HI的转化率都不变,而对2NH3(气)
H2(气)+I2(气),不论如何改变HI的浓度,HI的转化率都不变,而对2NH3(气)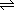 N2(气)+3H2(气),增加氨气的浓度时,氨气的转化率减小。
N2(气)+3H2(气),增加氨气的浓度时,氨气的转化率减小。
(二)、勒沙特列原理
如果改变影响平衡的一个条件(如浓度、压强或温度等)平衡就向能够减弱这种改变的方向移动。
对此原理的理解要注意以下几点:
1、它适用于所有的平衡体系,包括电离平衡、水解平衡、化学反应平衡等,也包括溶解和沉淀平衡等;
2、它只能判断平衡移动的方向,不能确定建立平衡的时间;
3、催化剂对反应的正逆方向的影响是相同的,故它对化学平衡不造成影响。