1、化学反应速率及其表示方法
化学反应速率是研究化学反应在单位时间内反应物或生成物浓度的变化量,即反应进行的快慢。通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示;单位是
mol·L-1·s-1 或 mol·L-1·min-1 或mol·L-1·h-1。
对于反应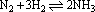 ,分别以三种物质来表示:
,分别以三种物质来表示:
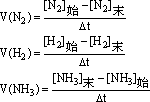
(1)同一化学反应用不同的物质来表示的速率,数值可能不同,但表示的意义相同。
(2)反应体系中,以不同物质表示的化学反应速率数值之比等于化学反应方程式中各物质的化学计量数之比。
(3)在化学计算中用到的速率,都是指某一段时间内的平均速率;只有在有关反应速率的图象中,用到瞬时速率。
(4)对于纯固体或纯液体参加的化学反应,因其密度不变,在反应中浓度也不改变,故不用纯固体、纯液体表示反应速率。
(5)化学反应速率的研究对象可以是可逆反应,也可以是进行完全的反应。
2、影响化学反应速率的因素

(1)浓度的影响
浓度对化学反应速率的影响规律:其他条件不变时,增大反应物浓度,可增大化学反应速率;减小反应物浓度,可减小化学反应速率。
此规律只适用于气体反应或溶液中的反应,对纯液体或固体反应物一般不适用(它们的浓度是常数)。因为固体体积与所含微粒个数成正比,增加固体物质的量,它的浓度几乎没有变化,不影响化学反应速率。一般情况下,将固体物质在一定温度下的浓度视为一常数,纯液体也视作浓度不变。但如果增大固体物质与其它反应物的接触面积,(如将块状加工成粉末状),可以使反应速率增大。
(2)压强的影响
压强对化学反应速率的影响规律:对于有气体的化学反应,其他条件不变,增大压强,可增大反应速率;减小压强,可减小反应速率。
此规律只适用于有气体参加或生成的反应,不适用于固体和溶液(压强的变化对它们的浓度几乎无影响)。对于既有气体参加,又有气体生成的可逆反应,增大压强,正反应速率、逆反应速率都增大;减小压强,两者都减小。
(3)温度的影响
动画演示:
温度对化学反应速率的影响规律:当其他条件不变时,升高温度,可以增大反应速率;降低温度,可以减慢反应速率。
无论是吸热反应还是放热反应,温度升高,反应速率都增大,只不过增大的幅度不同,吸热反应增大的幅度大,放热反应增大的幅度小。由实验测知,温度每升高10℃,反应速率通常增大到原来的2~4倍。
(4)催化剂的影响
催化剂分为正催化剂和负催化剂,正催化剂可以同等增大正、逆反应的速率,负催化剂可以同等减小正、逆反应的速率。若无特别说明,我们通常所说的都是指正催化剂,它可以使反应速率成千上万倍地增大。
必须明确:催化剂是参加反应的;使用催化剂时,要选择催化剂所需要的适宜温度,要防止催化剂中毒失效。
(5)其它因素的影响
如使反应物颗粒变小从而增大表面积;加大光照强度;采用不同的溶剂、电化学原理、超声波射线、激光、电磁波等对反应速率均有影响。
(6)惰性气体对反应速率的影响。
稀有气体或其他非反应气体,充入反应容器中,分以下两种情况讨论:
①若容器恒温、恒容,则充入的稀有气体或其他不反应气体虽改变了容器内气体压强,但却没有改变反应气体产生的分压,即并没改变反应物的浓度,不影响化学反应速率。
②若容器恒温、恒压,则充入的稀有气体或其他不反应气体,就会使容器容积扩大,虽未减少容器内气体压强,但却减小了反应气体产生的分压,即降低了反应物的浓度,故能使反应速率降低。
1、有效碰撞
物质发生化学反应时,首先是分子(或离子)必须接触碰撞,对气体分子而言,分子间碰撞的机率很大,但每次碰撞不一定能发生反应,只有那些有足够能量的分子,在一定的取向上碰撞,化学键断裂,原子(或离子)形成了新的化学键,才发生了化学反应,事实上能够发生反应的碰撞是很少的,有些物质,它的分子发生碰撞,但没有反应发生,例如:常温、常压下H2和O2的混合气体并不反应。
有效碰撞:能够发生化学反应的碰撞叫做有效碰撞。
2、活化分子
把发生有效碰撞的分子叫做活性化分子。
在一定的温度下,一种物质的分子具有一定的平均能量。对某一反应而言,必须有一部分具有比平均能量高的分子,它们才能发生有效碰撞,这种分子就是活化分子。
3、活化分子发生的碰撞不一定都是有效碰撞
反应物分子之间发生有效碰撞,必须同时满足两个条件,一是反应物分子的能量必须达到某一临界数值,二是反应物分子必须按一定的方向互相碰撞。前者是能量因素,后者是空间因素。
4、活化能
活化能:活化分子具有的最低能量与分子平均能量之差,叫做活化能。
5、活化能与反应热的关系
E2-E1>0 正反应是放热反应,逆反应是吸热反应。
E2-E1<0 正反应是吸热反应,逆反应是放热反应。
无论是吸热反应或放热反应,都需要一定的活化能才能反应。若E1<Q,当发生反应后,不需要外界供给能量,反应能不断进行。例如木炭燃烧时,若E1<Q,则在外界不供给能量时,木炭能继续燃烧。例如KClO3分解是放热反应,但放出的能量小于它反应时所需的活化能,所放出的能量不能使普通分子成为活化分子,因此要继续加热,否则反应停止进行。
6、用碰撞理论解释浓度、压强、温度、催化剂对化学反应速率的影响。
(1)浓度:在其他条件不变时,增大反应物浓度,单位体积内分子的总数增多,活化分子数也相应增多,因而单位时间内的有效碰撞次数增多,化学反应速率增大。
(2)压强:对于气体来说,其他条件不变时,增大压强即增大反应物的浓度,因而可以增大化学反应速率。
(3)温度:在其他条件不变时,升高温度,一方面反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子,反应物中活化分子百分数增多,单位时间内有效碰撞次数增多;另一方面分子的运动加快,单位时间里反应物分子间的碰撞次数增加,反应速率加快。但前者是反应加快的主要原因。
(4)催化剂:在其他条件不变时,使用催化剂,能降低反应的活化能,大大增加单位体积内活化分子的百分数,反应速率加快。
例1、(广东)对可逆反应4NH3(g)+5O2(g)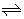 4NO(g) + 6H2O(g),下列叙述正确的是()
4NO(g) + 6H2O(g),下列叙述正确的是()
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x molNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容跑器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
答案:A
解析:
A中:4v正(O2)=5v逆(NO),而4v正(O2)=5v逆(NO),故v逆(NO)= v逆(NO),故达到化学平衡,B中所述均为一个方向上量的变化,不能说明v逆= v逆,故B不能说明达到化学平衡状态;C中对该反应,增大容器容积,化学反应速率均减慢,但逆反应速率减小的程度比正反应大,平衡逆向移动,D中的应为3v正(NH3)=2v正(H2O),故选A。
例2、将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:
2A(气)+B(气)=2C(气)
若经2s(秒)后测得C的浓度为0.6mol·L-1 ,现有下列几种说法:
①用物质A表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为 0.6 mol·L-1·s-1
③2s 时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A、①③ B、①④ C、②③ D、③④
答案:B
解析:
若用物质C表示反应的平均速率为0.6 mol·L-1 ÷2s=0.3 mol·L-1·s-1,又因为A、C物质的化学计量数相等,所以用A物质表示反应的平均反应速率也为
0.3 mol·L-1·s-1,说法①正确。用B物质表示反应的平均反应速率为0.15 mol·L-1·s-1。2s时A物质的转化率为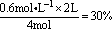 ,2s时消耗B物质0.6mol,此时B的浓度为(2-0.6)mol÷2L=0.7 mol·L-1,说法④正确,所以选项B符合题意。
,2s时消耗B物质0.6mol,此时B的浓度为(2-0.6)mol÷2L=0.7 mol·L-1,说法④正确,所以选项B符合题意。