(一)、铁的性质
1、铁位于第四周期第Ⅷ族,是过渡元素的代表,其原子结构示意图为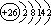 ,铁是一种变价元素,通常显+2、+3价,其化合物水溶液常带有颜色。
,铁是一种变价元素,通常显+2、+3价,其化合物水溶液常带有颜色。
2、铁在自然界中以化合态存在,分布很广,地壳中含量仅次于铝。铁矿石种类较多,重要的有:赤铁矿(主要成分Fe2O3),磁铁矿(主要成分Fe3O4),褐铁矿(主要成分Fe2O3·3H2O)和菱铁矿(FeCO3)。
3、铁较活泼,位于金属活动性顺序表H以前,可与H2O(气)、非氧化性酸反应产生H2,可被弱氧化剂氧化为+2价,也可被强氧化剂氧化为+3价。
4、铁的化学性质
(1)铁与硫、碘、非氧化性酸(H+)、盐溶液等弱氧化剂反应时,生成Fe2+
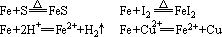
(2)铁与Cl2、Br2、硝酸等强氧化剂反应时,生成Fe3+化合物。
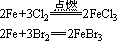
常温下,铁遇浓HNO3、浓H2SO4发生钝化。
(3)铁与O2和H2O(气)反应时生成Fe3O4(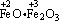 )
)

1、FeO与非氧化性酸(H+)反应,生成亚铁盐,但与强氧化性酸(如浓H2SO4、HNO3)反应,生成铁盐。
2、Fe3O4是复杂氧化物,可写成FeO·Fe2O3、Fe(FeO2)2,与非氧化性酸反应生成亚铁盐和铁盐,但与强氧化性酸反应,生成铁盐。
3、Fe与强氧化剂(如Cl2、Br2、HNO3)反应,可生成铁盐,与弱氧化剂(如S、I2)反应,生成亚铁盐。
4、铁化合物和亚铁化合物相互转变时的有关化学方程式
2FeCl2+Cl2=2FeCl3
2FeBr2+3Cl2(过量)=2FeCl3+2Br2
4FeCl2+O2+4HCl=4FeCl3+2H2O
12FeCl2+3O2=8FeCl3+2Fe2O3(露置于空气中)
3FeCl2+10HNO3=3Fe(NO3)3+6HCl+NO↑+2H2O
10FeCl2+2KMnO4+16H2SO4=K2SO4+5Fe2(SO4)3+2MnCl2+8H2O+16HCl
2FeCl3+2KI=I2+2FeCl2+2KCl
2FeCl3+H2S=S↓+2FeCl2+2HCl
2FeCl3+SO2+2H2O=H2SO4+2FeCl2+2HCl
2FeCl3+Fe=3FeCl2
2FeCl3+3Na2S(过量)=2FeS↓+S↓+6NaCl