*(一)、化学键
1、定义:分子(或晶体)中直接相邻的两个或多个原子间强烈的相互作用。
说明:
(1)原子通过化学键形成稳定结构。
如: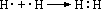
(2)原子间存在强烈作用
如拆开 1mol H2为H原子需436kJ能量。
(3)原子结合成分子后,体系能量降低。
如:H(g)+H(g)→H2(g)+436kJ
2、化学键的类型

(二)、离子键
1、定义:阴、阳离子通过静电作用形成化学键。
强调:
(1)成键的微粒:阴、阳离子
相互作用:静电作用(包括静电引力和静电斥力)
成键条件:活泼金属与活泼非金属。
其中碱金属和卤素之间都是离子键。
(2)离子键形成特点:有电子得失
(3)离子键表示方法:电子式
电子式:在元素符合周围用小黑点(或×)来表示原子的最外层电子的式子。
(三)、共价键
1、定义:原子间通过共用电子对(即电子云的重叠)所形成的化学键。
* 2、共价键三个物理量
(1)键能:是指1.01×105Pa和25℃下将1mol理想气体分子AB拆开为中性气态原子A和B时所需的能量。
单位: kJ·mol-1
特征:键能越大,共价键越牢固,含有该键的分子越稳定。
(2)键长:在分子中两个成键原子的核间平均距离叫键长,指原子间所形成的键。
特征:键长越短,键就越强、越牢固。
(3)键角:在分子中键与键之间的夹角叫键角。键角可反映分子的空间构型,可进一步帮助我们判断分子的极性。
3、极性共价键和非极性共价键
(1)非极性共价键:成键原子性质完全相同时,共用电子对在成键原子的正中间不偏向任何一方,或电子云在成键原子核之间中央区域最密集。如Cl—Cl等。
(2)极性共价键:成键原子的性质不完全相同,其电子对偏向成键的某原子。如H—Cl中电子对偏向Cl原子。
4、配位键(一种特殊的共价键)
定义:凡共用电子对仅由一个原子提供,而跟另一个原子或离子共用而形成的共价键。
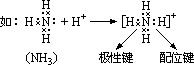
形成条件:在成键原子中,一方必须有孤对电子,另一方必须有容纳孤对电子的空轨道。