(一)、硫酸
1、物理性质
纯硫酸是一种无色油状液体,沸点高,难挥发;易溶于水,能与水以任意比混溶,且溶解时放出大量的热。常用浓硫酸的质量分数为98.3%,密度为1.84g/cm3,沸点338℃,物质的量浓度:
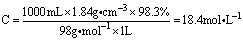
2、化学性质
硫酸在浓度不同的溶液中主要存在形式不同,因而具有不同的性质。稀硫酸中,由于硫酸安全电离,H2SO4=2H++SO42-,故H2SO4主要以H+、SO42-形式存在,其性质 一是具有酸的通性,二是SO42-的性质,如发生沉淀反应等。浓硫酸中,硫酸主要以分子形式存在,故主要如下特性:
(1)吸水性
吸水性是指H2SO4所具有的吸收游离水分的性能。这里的游离水分包括空气中所含的水蒸气,物质中的湿存水及结晶水合物中的结晶水等。
浓硫酸之所以能吸收游离的水分,是因为浓硫酸和水可以结合形成稳定的水合物H2SO4+nH2O=H2SO4·nH2O(n=1,2,4等)。这些水合物在低温时甚至可以以晶体的形式从溶液中析出。
浓硫酸可作干燥剂,可干燥O2、H2、CO、CO2、SO2、Cl2、HCl、N2、CH4等气体。对于那些还原性及碱性的气体,如HI、HBr、H2S、NH3等,则不能用浓硫酸干燥。
(2)脱水性
脱水性是指浓H2SO4将许多有机物(特别是糖类)中的H、O原子按照水分子中H、O原子个数比脱去的性质。
浓硫酸对人体皮肤有强烈的腐蚀作用。如果不慎在皮肤上沾上浓硫酸时,应立即用布拭去,然后迅速用大量水冲洗,最后涂上3%—5%的NaHCO3溶液。
检验浓硫酸最简便的方法——蘸浓H2SO4在纸上写字。
(3)强氧化性
浓硫酸可氧化大多数金属(除Pt和Au)和其他还原性物质(如H2S、HBr、HI、Fe2+等)

注意:
①往蔗糖中滴加一定量的浓H2SO4,加热。
观察到现象是蔗糖变黑,最终生成疏松多孔、海绵状的特质,并有刺激性气味的气体产生。
有关的化学方程式为:
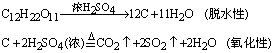
②钝化:常温下,一些较活泼金属(如Fe,Al等)与浓H2SO4接触,在金属表面形成一层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应。金属的钝化是化学变化,不是物理变化。
③浓H2SO4的贮存、运输:常温下,可用密闭的铁或铝制容器、贮存、运输浓H2SO4。
④金属与浓H2SO4反应时,金属一般被氧化成较高价态的硫酸盐,还原产物是SO2,不是H2,非金属与浓H2SO4反应时,非金属一般被氧化成最高价氧化物或含氧酸,浓硫酸一般被还原为SO2。
3、用途
(1)制化肥
如制普钙(即过磷酸钙):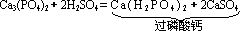
(2)合成某些试剂的原料
如制挥发性酸: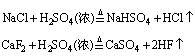
制弱酸: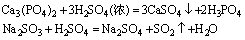
(3)可用作干燥剂、酸洗、制炸药、农药、医药、染料等
(二)、硫酸根离子的检验
原理:由于BaSO4不溶于水,也不溶于酸,故可利用可溶性钡盐来检验SO42-,但须排除CO32-、PO43-、Ag+、SO32-的干扰。
Ba2++SO42-=BaSO4↓
方法:取待测液,先加过量盐酸,无明显现象,再加BaCl2溶液,若有白色沉淀生成,即证明原待测液中含SO42-。
(三)、环境保护
1、大气污染及防治
(1)大气污染物:颗粒物(粉尘)、SO2、NOx、CO、碳氢化合物、含卤素化合物、放射性物质等。
(2)大气污染的危害:①危害人体健康;②影响动、植物生长;③破坏建筑材料;④改变世界的气候。
(3)大气污染的防治:调整能源结构;合理规划工业发展和城市建设布局;运用各种防治污染的技术;制订大气质量标准;加强大气质量监测;充分利用环境自净能力。
2、水污染及防治
(1)水污染源:工业废水、生活污水、农田排水、垃圾渗漏等。
(2)水污染物种类:重金属(Ba2+、Pb2+等)、酸、碱、盐等无机物,耗氧物质,石油和难降解的有机物,洗涤剂等。
(3)水污染的防治:控制污水的任意排放。
3、土壤的污染及防治
(1)土壤污染:如果进入土壤的污染物的数量超过了土壤的净化能力,就会引起土壤质量下降,这种现象叫做土壤污染。
(2)土壤污染物:城市污水、工业废水、生活垃圾、工矿企业固体废弃物、化肥、农药、大气沉降物、牲畜排泄物、生物残体等。
(3)防治土壤污染的措施:控制和减少污染物的排放。