|
一、一周知识概述
本周讲述第五章第三节:元素周期表。内容包括元素周期表的结构、反映的规律、应用、意义;原子结构、元素性质和在元素周期表中位置三者的关系;同位素及元素的相对原子质量。
二、重点、难点、知识剖析
(一)、元素周期表的结构
1、元素周期表的排列原则
(1)按原子序数递增的顺序从左到右排列;
(2)将电子层数相同的元素排成一个横行;
(3)把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行。
2、周期表的结构:(7个周期,16个族)
(1)周期:具有相同电子层数而又按原子序数递增顺序排列的一系列元素。
周期序数=(该周期元素原子的)电子层数
(2)族:最外层电子排布(外围电子排布)相似的同一纵行的元素,称之为一族。
主族序数=最外层电子数=最高正化合价
(3)
(二)、元素性质与元素在周期表中的位置关系
1、元素的金属性和非金属性在元素周期表中位置关系
(1)同周期:从左到右,核电荷数依次增多、原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,因此,金属性逐渐减弱,非金属性逐渐增强。(稀有气体除外)
(2)同主族:从上到下电子层数增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,所以金属的金属性逐渐增强,非金属性逐渐减弱。
2、元素化合价与元素周期表中位置关系
(1)价电子:元素原子最外层电子(有时次外层、倒数第三层中电子也叫价电子。)
(2)主族元素最高正化合价=主族序数(最外层电子数)
负化合价=主族序数-8
或:负化合价=-(8-主族序数)
(3)“位—构—性”之间的关系
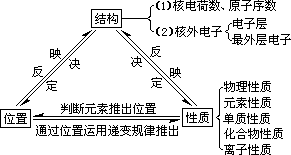
(三)、同位素和元素的相对原子质量
1、同位素
(1)概念:具有相同质子数和不同的中子数的原子互称为同位素,如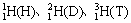 就互为同位素。 就互为同位素。
(2)同位素的特点
①同种元素可以有若干种不同的原子。至今已发现了 116种元素,但发现的原子远多于116种。
②核电荷数相同的不同原子,虽然它们的中子数不同,但属于同种元素。
③同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物性质几乎完全相同,只是某些物理性质略有差异。
2、元素的相对原子质量
(1)概念:根据元素天然同位素所占的原子个数百分比和同位素的相对原子质量,计算出该元素的相对原子质量。
(2)计算式:Ar(E)=Ar(E1)·a%+Ar(E2)·b%+Ar(E3)·c%+……式中Ar(E1)、Ar(E2)、Ar(E3)分别为同位素的相对原子质量,a%、b%、c%分别为自然界中各种天然同位素原子所占原子个数的百分比。
- 返回 -
|